Описание КАБОМЕТИКС таблетки, п/плен. обол. по 60 мг №30 в бутыл.
ИНСТРУКЦИЯ
для медицинского применения лекарственного средства
КАБОМЕТИКС
(CABOMETYX®)
Состав:
действующее вещество: кабозантиниб (S)-малат
1 таблетка, покрытая плёночной оболочкой, содержит кабозантинибу (S)-малата, что эквивалентно кабозантинибу 20 мг, или 40 мг, или 60 мг;
другие составляющие: целлюлоза микрокристаллическая, лактоза безводная, гидроксипропилцеллюлоза, натрия кроскармелоза, кремния диоксид коллоидный (безводный), магния стеарат;
пленочная оболочка: опадрай желтый (03K92254): гипромелоза (HPMC) 2910 (Е 464), титана диоксид (Е 171), триацетин, железа оксид желтый (Е 172).
Лекарственная форма.
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства.
КАБОМЕТИКС, таблетки, покрытые плёночной оболочкой, по 20 мг
Круглые таблетки, покрытые плёночной оболочкой, желтого цвета, с тиснением «XL» на одной стороне и «20» на другой стороне таблетки.
КАБОМЕТИКС, таблетки, покрытые плёночной оболочкой, по 40 мг
Треугольные таблетки, покрытые пленочной оболочкой, желтого цвета с тиснением «XL» на одной стороне и «40» на другой стороне таблетки.
КАБОМЕТИКС, таблетки, покрытые плёночной оболочкой, по 60 мг
Овальные таблетки, покрытые плёночной оболочкой, желтого цвета, с тиснением «XL» на одной стороне и «60» на другой стороне таблетки.
Фармакотерапевтическая группа.
Антинеопластические лекарственные средства. Ингибиторы протеинкиназы. Кабозантиниб.
Код ATX L01XE26.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Кабозантиниб – низкомолекулярный ингибитор тирозинкиназы, ингибирующий множественные рецепторные тирозинкиназы (RTKs), участвующие в процессах роста опухолей и ангиогенеза, патологического изменения костной ткани, устойчивости к лекарственным средствам и метастатической прогрессии опухоли. В результате оценки ингибирующей активности против различных киназ кабозантиниб был определен ингибитором рецепторов МЭТ (рецептор фактора роста гепатоцитов) и рецепторов VEGF (фактор роста эндотелия сосудов). Кроме того, кабозантиниб ингибирует другие тирозинкиназы, включая GAS6-рецептор (AXL), RET, ROS1, TYRO3, MER, рецептор фактора стволовых клеток (КИТ), TRKB, Fms-подобную тирозинкиназу-3 (FLT3) и ТИЭ-2.
Фармакодинамические эффекты
Кабозантиниб показал угнетение роста опухоли, связанную с дозой, регресс опухоли и/или угнетенное метастазирование в широком диапазоне доклинических моделей опухоли.
Кардиологическая электрофизиология
Увеличение от исходного уровня в коррегированном интервале QT с корректировкой Фридериция (QTcF) на 10–15 мсек на 29-й день (но не на 1-й день) после начала лечения кабозантинибом (в дозе 140 мг в день) наблюдалось в контролируемом клиническом исследовании с участием больных медуллярным раком щитовидной железы. Этот эффект не связан с морфологическими изменениями предсердной волны или возникновением новых сердечных ритмов. В этом исследовании ни один пациент, получавший кабозантиниб, не имел подтвержденного QTcF > 500 мсек, что не было подтверждено при лечении НКК или ГЦК (в дозе 60 мг).
Клиническая эффективность и безопасность
Клинические данные по почечноклеточной карциноме (НКК) после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF)
Безопасность и эффективность лекарственного средства КАБОМЕТИКС при лечении почечноклеточной карциномы после предварительного лечения средствами, влияющими на VEGF, оценивали в рандомизированном открытом многоцентровом исследовании ІІІ фазы (METEOR). Пациенты с распространенной светоклеточной почечноклеточной карциномой (НКК), ранее получавшие по меньшей мере 1 курс лечения ингибиторами рецепторов тирозинкиназы VEGF (VEGFR TKI), были рандомизированы (1:1) для приема КАБОМЕТИКСА (N = 330) или N=330. Пациенты могли получать другие предыдущие курсы терапии, включая цитокины или антитела, направленные на VEGF, на рецепторы запрограммированной клеточной смерти-1 (PD-1) или его лиганды. Допускались ранее леченные пациенты с метастазами в мозг. Выживаемость без прогрессирования заболевания оценивалась комитетом по проведению слепой независимой радиологической экспертизы, а первичный анализ был проведен среди первых 375 рандомизированных пациентов. Вторичными конечными точками были доля пациентов с объективным ответом и общая выживаемость. Оценки опухоли проводились каждые 8 недель в течение первых 12 месяцев, затем через каждые 12 недель.
Базовые демографические показатели и характеристики заболевания были сходными в группах, принимавших Кабометикс и эверолимус. Большинство пациентов были мужского пола (75%), средний возраст – 62 года. 71% пациентов получили только один предварительный курс VEGFR TKI; 41% пациентов получили суннитин как единственный предварительный курс VEGFR TKI. Согласно критериям прогностической категории риска Мемориального онкологического центра Слоана-Кеттеринга (MSKCC), 46% имели благоприятное течение (0 факторов риска), 42% - промежуточный (1 фактор риска), 13% - плохое (2 или 3 фактора риска). 54% пациентов имели 3 или более органов с метастазами, включая легкие (63%), лимфатические узлы (62%), печень (29%) и кости (22%). Средняя продолжительность лечения составляла 7,6 месяца (диапазон 0,3–20,5) у пациентов, получавших КАБОМЕТИКС, и 4,4 месяца (диапазон 0,21–18,9) у пациентов, получавших эверолимус.
Статистически значимое улучшение выживаемости без прогрессирования заболевания наблюдается при применении КАБОМЕТИКСА по сравнению с эверолимусом (таблица 1). Планируемый промежуточный анализ общей выживаемости проводился при анализе выживаемости без прогрессирования заболевания и не достиг предела статистической значимости (202 явления, НR = 0,68 [0,51, 0,90], р = 0,006). В следующем незапланированном промежуточном анализе общей выживаемости было показано статистически значимое улучшение у больных, принимавших КАБОМЕТИКС, по сравнению с группой эверолимуса (320 явлений, медиана 21,4 месяца и 16,5 месяца, НR = 0,66 [0,53, 0, 83], р=0,0003). Сравненные результаты по ЗВ наблюдались при дальнейшем (дескриптивном) анализе 430 явлений.
Исследовательский анализ выживаемости без прогрессирования заболевания и общей выживаемости в группе «все рандомизированные пациенты, получившие не менее одной дозы исследуемого лекарственного средства» также показал надежные результаты в пользу КАБОМЕТИКСА по сравнению с эверолимусом в разных подгруппах в соответствии с возрастом (до < 65 лет по сравнению с > 65 лет, пол, группа риска Мемориального онкологического центра Слоана-Кеттеринга (благоприятный, промежуточный, плохой), ECOG статус (0 или 1), время от постановки диагноза до рандомизации (до <1 года по сравнению с >1 года), МЕТ статус опухоли (высокий по сравнению с низким или неизвестным), метастазы в костях (отсутствие по сравнению с наличием), висцеральные метастазы (отсутствие по сравнению с присутствием), метастазы в костях и висцеральные метастазы (отсутствие по сравнению с наличием), количество предыдущих курсов VEGFR-TKI (1 сравнительно >2), длительность первого VEGF (< 6 месяцев сравнительно > 6 месяцев) Результаты относительно доли пациентов с объ тивным ответом приведены в таблице 2.
Кривая выживаемости без прогрессирования заболевания, определенной независимым комитетом радиологической экспертизы у пациентов с НКК после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF) (первые 375 рандомизированных пациентов) (метод Каплана-Мейера, исследование METEOR)
Количество пациентов группы риска
КАБОМЕТИКС
Эверолимус
Подпись: Вероятность выживаемости без прогрессирования КАБОМЕТИКС
Эверолимус
Луне
Таблица 1
Резюме результатов выживаемости без прогрессирования заболевания (ВБПЗ), определенное независимым комитетом радиологической экспертизы у пациентов с НКК после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF) (исследование METEOR)
|
Первичный анализ ОПНС популяции |
Популяция ИВС |
|||
|
Конечная точка |
КАБОМЕТИКС |
Эверолимус |
КАБОМЕТИКС |
Эверолимус |
|
N=187 |
N=188 |
N=330 |
N=328 |
|
|
Медиана времени ОБПЗ (95% ДИ – доверительный интервал), месяцы |
7,4 (5,6; 9,1) |
3,8 (3,7; 5,4) |
7,4 (6,6; 9,1) |
3,9 (3,7; 5,1) |
|
Соотношение рисков (HR) (95% ДИ), p-значение 1 |
0,58 (0,45; 0,74), p<0,0001 |
0,51 (0,41; 0,62), p<0,0001 |
||
1 Стратифицированный логарифмический ранговый критерий
Кривая общей выживаемости пациентов с НКК после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF) (метод Каплана-Мейера, исследование METEOR)
Количество пациентов группы риска
КАБОМЕТИКС
Эверолимус
Подпись: Вероятность общей выживаемости КАБОМЕТИКС
Эверолимус
Луне
Таблица 2
Резюме данных о количестве пациентов с объективным ответом согласно отчету независимого комитета радиологической экспертизы (IRC) и отчета исследователей среди больных НКК после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF)
(VEGF)
|
Конечная точка |
Первичный анализ показателя объективного ответа в популяции ИВС, данные IRC |
Показатель объективного ответа в популяции ИВС, данные исследователей |
||
|
КАБОМЕТИКС |
Эверолимус |
КАБОМЕТИКС |
Эверолимус |
|
|
N=330 |
N=328 |
N=330 |
N=328 |
|
|
Показатель объективного ответа (только частичный объективный ответ) (ДИ 95%) |
17% (13%, 22%) |
3% (2%, 6%) |
24% (19%, 29%) |
4% (2%, 7%) |
|
p-значение 1 |
p<0,0001 |
p< 0,0001 |
||
|
Частичный ответ |
17% |
3% |
24% |
4% |
|
Медиана времени до первого ответа, месяцы (ДИ 95%) |
1,91 (1,6; 11,0) |
2,14(1,9; 9,2) |
1,91 (1,3; 9,8) |
3,50 (1,8;5,6) |
|
Стабилизация заболевания как лучший ответ |
65% |
62% |
63% |
63% |
|
Прогрессирование заболевания как лучший ответ |
12% |
27% |
9% |
27% |
1 Критерий хи-квадрат
Клинические данные по лечению пациентов с почечноклеточной карциномой, ранее не получавших лечение
Безопасность и эффективность применения лекарственного средства КАБОМЕТИКС у пациентов с почечноклеточной карциномой, ранее не получавших лечение, оценивали в рандомизированном открытом многоцентровом исследовании (CABOSUN). Пациенты (N=157) с ранее нелеченной, местно-распространенной или метастатической светоклеточной НКК были рандомизированы (1:1) для получения лекарственного средства КАБОМЕТИКС (N=79) или суннитиба (N=78). Пациенты должны были иметь заболевание среднего или высокого риска в соответствии с определениями категорий риска по классификации Международного консорциума баз данных метастатических форм НКК (IMDC). Пациенты были стратифицированы по группе риска IMDC и наличию костных метастазов (да/нет). Около 75% пациентов перенесли операцию по удалению почки до начала лечения.
Пациент должен был иметь один или два из указанных факторов риска в случае среднего риска и три или более факторов в случае высокого риска: время с момента диагностики НКК до системного лечения < 1 года, гемоглобин < НМН (нижняя граница нормы), корректируемый уровень кальция > ВМН (верхний предел нормы), индекс KPS < 80%, нейтрофилы > ВМН, тромбоциты > ВМН.
Первоначальной конечной точкой была выживаемость без прогрессирования заболевания. Вторичные конечные точки эффективности были определены как показатель объективного ответа и всеобщая выживаемость. Оценку опухоли производились каждые 12 недель.
Исходные демографические показатели и характеристики заболевания были аналогичными в группах применения лекарственного средства КАБОМЕТИКС и суннитин. Большинство пациентов были мужчинами (78%); средний возраст – 62 года. Распределение пациентов по группам риска IMDC было следующим: 81% пациентов в группе среднего риска (1-2 фактора риска), а 19% – в группе высокого риска (≥3 факторов риска). Большинство пациентов (87%) имели оценку по функциональному статусу ECOG 0 или 1; 13% – оценка 2. Костные метастазы выявлены у 36% пациентов.
Статистически значимое улучшение выживаемости без прогрессирования заболевания, ретроспективно оценивавшего независимый комитет по проведению слепой радиологической экспертизы (IRC), продемонстрировало преимущества в пользу лекарственного средства КАБОМЕТИКС по сравнению с суннитибом (таблица 3). Результаты анализа, проведенного исследователем и IRC относительно определения выживаемости без прогрессирования заболевания согласовывались между собой.
Пациенты с положительным и отрицательным статусом МЭТ демонстрировали благоприятный эффект лекарственного средства КАБОМЕТИКС по сравнению с суннитином; причем большая активность наблюдалась у пациентов с положительным статусом МЭТ по сравнению с пациентами с отрицательным статусом MET (HR = 0,32 (0,16, 0,63) по сравнению с 0,67 (0,37, 1,23)), соответственно.
Терапию лекарственным средством КАБОМЕТИКС связывали с тенденцией к более длительной выживаемости по сравнению с суннитином (таблица 3). Это исследование было недостаточно мощным для анализа всеобщей выживаемости, а полученные данные были незрелыми.
Данные по отношению к показателю объективного ответа приведены в таблице 3.
Кривая выживаемости без прогрессирования заболевания у пациентов с НКК, ранее не получавших лечение (данные IRC, метод Каплана-Мейера)
Количество пациентов группы риска
КАБОМЕТИКС
Эверолимус
КАБОМЕТИКС
Эверолимус
Луне
Подпись: Вероятность выживаемости без прогрессирования заболевания Таблица 3
Результаты эффективности у пациентов с НКК, ранее не получавших лечение (популяция ITT, исследование CABOSUN)
|
Показатель |
КАБОМЕТИКС (N=79) |
Сунитиниб (N=78) |
|
Выживаемость без прогрессирования заболевания по данным IRC а |
||
|
Медиана выживаемости без прогрессирования (95% ДИ) |
8,6 (6,2; 14,0) |
5,3 (3,0; 8,2) |
|
HR (95% ДИ); стратифицировано бы, в |
0,48 (0,32; 0,73) |
|
|
Двухстороннее, логарифмическое ранговое p-значение: стратифицировано б |
p=0,0005 |
|
|
Выживаемость без прогрессирования заболевания по данным исследователя |
||
|
Медиана выживаемости без прогрессирования (95% ДИ) |
8,3 (6,5; 12,4) |
5,4 (3,4; 8,2) |
|
HR (95% ДИ), стратифицировано б, в |
0,56 (0,37; 0,83) |
|
|
Двухстороннее, логарифмическое ранговое p-значение: стратифицировано б |
p=0,0042 |
|
|
Общая выживаемость |
||
|
Медиана общей выживаемости в месяцах (95% ДИ) |
30,3 (14,6; NE) |
21,0 (16,3; 27,0) |
|
HR (95% ДИ), стратифицировано б, в |
0,74 (0,47; 1,14) |
|
|
Показатель объективного ответа, n(%) по данным IRC |
||
|
Полные ответы |
0 |
0 |
|
Частичные ответы |
16 (20) |
7 (9) |
|
Объективный ответ (только частные ответы) |
16 (20) |
7 (9) |
|
Стабилизация заболевания |
43 (54) |
30 (38) |
|
Прогрессирование заболевания |
14 (18) |
23 (29) |
|
Показатель объективного ответа, n(%) по данным исследователя |
||
|
Полные ответы |
1 (1) |
0 |
|
Частичные ответы |
25 (32) |
9 (12) |
|
Объективный ответ (только частные ответы) |
26 (33) |
9 (12) |
|
Стабилизация заболевания |
34 (43) |
29 (37) |
|
Прогрессирование заболевания |
14 (18) |
19 (24) |
а Согласно принятому в ЕС цензуровке данных.
б Факторы стратификации в соответствии с IxRS включали категории рисков IMDC (средний риск, высокий риск и метастазы в костях (да/нет)).
на основе модели пропорциональных рисков Кокса с корректировкой на факторы стратификации в соответствии с IxRS. Отношение рисков < 1 указывает на выживаемость без прогрессирования в пользу кабозантиниба .
Клинические данные при гепатоцеллюлярной карциноме (ГЦК)
Безопасность и эффективность лекарственного средства Кабометикс оценивали в рандомизированном двойном слепом плацебо-контролируемом исследовании фазы III (CELESTIAL). Пациенты (N=707) с ГЦК, не реагирующей на радикальное лечение и ранее получавшие сорафениб в связи с распространенной формой заболевания, были рандомизированы (2:1) для получения лекарственного средства КАБОМЕТИКС (N=470) или плацебо ( N=237). Пациенты могли получать еще одну предварительную системную терапию в связи с распространенной формой заболевания в дополнение к сорафенибу. Рандомизация была стратифицирована по этиологии заболевания (вирус гепатита В [с или без вируса гепатита С], вирус гепатита С [без вируса гепатита В] или другая категория пациентов), географическому региону (Азия, другие регионы) и при наличии экстрагепатического распространения заболевания и/ или макроваскулярных инвазий (да/нет).
Первоначальная конечная точка эффективности была определена как всеобщая выживаемость. Вторичными конечными точками эффективности была выживаемость без прогрессирования заболевания и показатель объективного ответа, оцениваемых исследователем с использованием Критериев оценки ответа на лечение при солидных опухолях (RECIST) 1.1. Опухоли оценивали каждые 8 недель. Субъекты продолжали лечение слепым методом после радиологического подтверждения прогрессирования заболевания, пока они испытывали клинические преимущества или пока не возникнет необходимость в дальнейшей системной терапии или местной, направленной на противоопухолевую печеню. Переход с плацебо к кабозантинибу не допускался во время слепой фазы лечения.
Базовые демографические показатели и характеристики заболевания были сходными между группами применения лекарственного средства КАБОМЕТИКС и плацебо и представлены ниже для всех 707 рандомизированных пациентов:
Мужчины: 82%
Средний возраст: 64 года.
Европеоидная раса: 56%, азиаты: 34%
Оценка функционального статуса по критериям ECOG на уровне 0:53% или на уровне 1:47%
Печеночная недостаточность степени А по классификации Чайлда – Пью: 99%, степени В: 1%
Этиология ГКК включала 38% пациентов с вирусом гепатита В (ВГВ), 21% с вирусом гепатита С (ВГС), 40% других (ни ВГВ, ни ВГС).
Наличие макроскопической сосудистой инвазии и внепеченочной опухоли: 78%.
Уровни альфа-фетопротеина (AFP) ≥400 мкг/л: 41%.
Местно-регионарная трансартериальная эмболизация или процедуры хемоинфузии: 44%
Лучевая терапия перед лечением кабозантинибом: 37%
Медиана длительности лечения сорафенибом: 5,32 месяца
72% пациентов получали один, а 28% - 2 предварительные схемы системной терапии для лечения распространенной формы заболевания.
Статистически значимое улучшение общей выживаемости было продемонстрировано для лекарственного средства КАБОМЕТИКС в отношении плацебо (таблица 4).
Данные по выживаемости без прогрессирования заболевания и показатель объективного ответа представлены в таблице 4.
Таблица 4
Результаты эффективности у пациентов с ГЦК (популяция ITT, исследование CELESTIAL)
|
Показатель |
КАБОМЕТИКС (N=470) |
Платебо (N=237) |
|
Общая выживаемость |
||
|
Медиана общей выживаемости (95% ДИ), месяцы |
10,2 (9,1; 12,0) |
8,0 (6,8; 9,4) |
|
HR (95% ДИ) 1,2 |
0,76 (0,63; 0,92) |
|
|
p-значение 1 |
p=0,0049 |
|
|
|
||
|
Выживаемость без прогрессирования заболевания 3 |
||
|
Медиана выживаемости без прогрессирования (95% ДИ) |
5,2 (4,0; 5,5) |
1.9 (1.9; 1.9) |
|
HR (95% ДИ) 1 |
0,44 (0,36; 0,52) |
|
|
p-значение 1 |
p<0,0001 |
|
|
Расчет частицы пациентов без определенных событий через 3 месяца после лечения (метод Каплана-Мейера) |
||
|
% (95% ДИ) |
67,0% (62,2%; 71,3%) |
33,3% (27,1%; 39,7%) |
|
Показатель объективного ответа, n(%) 3 |
||
|
Полные ответы (CR) |
0 |
0 |
|
Частичные ответы (PR) |
18 (4) |
1 (0,4) |
|
Объективный ответ (CR+PR) |
18 (4) |
1 (0,4) |
|
p-значение 1,4 |
p=0,0086 |
|
|
Стабилизация заболевания |
282 (60) |
78 (33) |
|
Прогрессирование заболевания |
98 (21) |
131 (55) |
1 2-сторонний, стратифицированный, логарифмический ранговой критерий, в котором факторами стратификации являются этиология заболевания (вирус гепатита В [с или без вируса гепатита С], вирус гепатита С [без вируса гепатита В] или другая категория пациентов), географический регион (Азия , другие регионы) и наличие экстрагепатического распространения заболевания и/или макроваскулярных инвазий (да/нет) (по данным IVRS).
2 Рассчитаны на основе модели пропорциональных рисков Кокса.
3 По оценке исследователя в соответствии с критериями RECIST 1.1.
4 Стратифицированный критерий Кохрана-Мантеля-Гензеля (CMH).
Луне
Количество пациентов группы риска
КАБОМЕТИКС
Платебо
КАБОМЕТИКС
Платебо
Подпись: Достоверность выживаемости без прогрессирования заболевания
Доля системной лучевой и локальной направленной на печень системной противоопухолевой терапии не по протоколу (NPACT) составляла 26% в группе применения кабозантиниба и 33% в группе плацебо. Пациентам, получавшим такие виды терапии, пришлось прекратить лечение изучаемым режимом. Поисковый анализ общей выживаемости с цензурированием данных по применению NPACT обеспечил данные в поддержку результатов первичного анализа: показатель HR, скорректированный на факторы стратификации (на IxRS), составил 0,66 (95% ДИ: 0,52, 0,84; стратифицированное логарифмическое рангово p-значение =0,0005). Расчет средней продолжительности общей выживаемости методом Каплана-Мейера составил 11,1 месяца в группе кабозантиниба по сравнению с 6,9 месяцами в группе плацебо, что дает расчетное отличие в медианах на уровне 4,2 месяца.
Качество жизни оценивали без привязки к конкретному заболеванию (QoL) с помощью опросника EuroQoL EQ-5D-5L. Негативное влияние лекарственного средства КАБОМЕТИКС по сравнению с плацебо на показатель индекса полезности EQ-5D наблюдалось в течение первых недель лечения. После этого периода доступны только ограниченные данные QoL.
Педиатрическая популяция
Европейское агентство по лекарственным средствам отменило обязательство представить результаты исследований лекарственного средства КАБОМЕТИКС во всех подгруппах педиатрической популяции по лечению гепатоцеллюлярной карциномы, а также карцином почек и почечной миски (за исключением нефробластомы, нефробластоматоза опухоли почек) (см. раздел "Способ применения и дозы" относительно информации о применении лекарственного средства у детей).
Фармакокинетика.
Абсорбция
После перорального введения пиковая концентрация кабозантиниба в плазме крови достигается через 3–4 часа. Профили концентрации в плазме в зависимости от времени показывают второй пик абсорбции примерно через 24 часа после введения, что свидетельствует о том, что кабозантиниб может пройти кишечно-печеночную рециркуляцию.
Повторное ежедневное применение кабозантиниба в дозе 140 мг в течение 19 дней привело к увеличению среднего накопления кабозантиниба примерно в 4–5 раз (на основе площади под фармакокинетической кривой «концентрация–время») по сравнению с однократным введением дозы; стабильное состояние достигнуто примерно на 15 день.
Пища с высоким содержанием жира умеренно повысила максимальную концентрацию действующего вещества в плазме крови и значение площади под фармакокинетической кривой «концентрация-время» (41% и 57% соответственно) по сравнению с состояниями натощак у здоровых добровольцев, принимавших перорально одну дозу кабозантиниба, что составляла 140 мг. Информация о влиянии пищи, принятой через 1 час после введения кабозантиниба, отсутствует.
Биологическая эквивалентность не могла быть продемонстрирована между кабозантинибом в капсулах и таблетках после введения разовой дозы 140 мг здоровым добровольцам. Наблюдалось увеличение на 19% максимальной концентрации действующего вещества в плазме крови после введения таблетки (КАБОМЕТИКС) по сравнению с капсулой (КОМЕТРИК). Менее 10% разница показателей площади под фармакокинетической кривой «концентрация-время» наблюдалась после приема таблеток кабозантиниба (КАБОМЕТИКС) и капсул (КОМЕТРИК).
Распределение
Кабозантиниб обладает высокой степенью связывания с белком плазмы человека (≥99,7%). На основании измерения фармакокинетических показателей объем распределения (Vz) составляет примерно 212 л. Связывание с белками плазмы крови не изменялось у пациентов с легкими или умеренными нарушениями функции почек или печени.
Биотрансформация
Кабозантиниб метаболизируется in vivo. Четыре метаболита были в плазме крови при уровнях воздействия (площадь под фармакокинетической кривой «концентрация-время») более 10% от исходных метаболитов: XL184-N-оксид, продукт расщепления амида XL184, моногидроксисульфат XL184 и сульфат продукта расщепления. Два неконъюгированных метаболита (XL184-N-оксид и продукт расщепления амида XL184) имеют <1% целевой активности ингибирования киназы исходного кабозантиниба, каждый из них составляет <10% общего влияния на плазму крови, связанного с лекарственным средством.
Кабозантиниб представляет собой субстрат для метаболизма CYP3A4 in vitro, поскольку нейтрализующее антитело к CYP3A4 ингибирует образование метаболита XL184-N-оксида на >80% в микросомальной инкубации печени человека, катализируемой NADPH; для сравнения, нейтрализующие антитела к CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 и CYP2E1 не влияли на образование метаболитов кабозантиниба. Нейтрализующее антитело к CYP2C9 показало минимальное влияние на образование метаболита кабозантиниба (т.е. снижение <20%).
Вывод
При пероральном применении кабозантиниба в дозах от 20 до 140 мг среднее время полувыведения из плазмы крови кабозантиниба по данным исследований с участием 1883 пациентов и 140 здоровых добровольцев составляет около 110 часов. Средний плазменный клиренс (воображаемый клиренс) равен почти 2,48 л/ч после стабильной экспозиции. Около 81% меченной изотопами дозы выявляли в течение 48 суток после применения однократной дозы 14C-кабозантиниба у здоровых добровольцев, при этом почти 54% дозы выводилось с калом, а около 27% - выводилось с мочой.
Фармакокинетика в особых группах пациентов
Почечная недостаточность
Результаты исследования с участием пациентов с почечной недостаточностью, с применением однократной дозы кабозантиниба 60 мг, указывают на то, что соотношение среднего геометрического значения, рассчитанного методом наименьших квадратов, для кабозантиниба в плазме крови, максимальной концентрации действующего вещества в плазме крови и площади под фармако «концентрация – время» от 0 до бесконечности были на 19% и 30% выше для пациентов с легкой формой почечной недостаточности (ДИ 90% для максимальной концентрации действующего вещества в плазме крови от 91,60% до 155,51%; площади под фармакокинетической кривой, описывающей зависимость «концентрация–время», от 0 до бесконечности от 98,79% до 171,26%) и на 2% и на 6–7% выше (ДИ 90% для максимальной концентрации действующего вещества в плазме крови от 78,64% до 133,52%, площади под фармакокинетической кривой «концентрация – время» от 0 до бесконечности от 79,61% до 140,11%) у пациентов с умеренной степенью почечной недостаточности по сравнению с пациентами с нормальной функцией почек. Пациенты с ОПН не изучались.
Печеночная недостаточность
По результатам интегрированного анализа популяционной фармакокинетики кабозантиниба у здоровых добровольцев и больных раком (в т.ч. ГЦК) клинически значимого различия среднего уровня экспозиции кабозантиниба в плазме не наблюдали среди пациентов с нормальной функцией печени (n=1425) и легкой формой. n=558). Данные относительно пациентов со средней формой печеночной недостаточности (n=15) по критериям NCI-ODWG (Рабочей группы по дисфункциям органов при Национальном институте рака (США)) ограничены. Фармакокинетику кабозантиниба не оценивали у пациентов с печеночной недостаточностью тяжелой степени.
Роса
Популяционный фармакокинетический анализ не выявил клинически значимых разногласий в фармакокинетике кабозантиниба в зависимости от расы пациента.
Клинические свойства.
Показания.
Почечноклеточная карцинома (НКК)
КАБОМЕТИКС показан для лечения распространенной почечноклеточной карциномы (НКК):
- Mу взрослых пациентов, ранее не получавших лечение и имеющих средний или высокий риск (см. раздел «Фармакодинамические свойства»);
- Mу взрослых пациентов после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF).
Гепатоцеллюлярная карцинома (ГЦК)
КАБОМЕТИКС показан как монотерапия гепатоцеллюлярной карциномы (ГЦК) у взрослых пациентов, ранее получавших лечение сорафенибом.
Противопоказания.
Гиперчувствительность к действующему веществу или любому из вспомогательных веществ лекарственного средства.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Влияние других лекарственных средств на кабозантиниб
Ингибиторы и индукторы CYP3A4
Предварительный прием кетоконазола, мощного ингибитора CYP3A4, в дозе 400 мг 1 раз в сутки в течение 27 дней перед применением разовой дозы кабозантиниба, увеличивал содержание кабозантиниба в плазме крови на 38% (AUC) и уменьшал клиренс кабозантиниба на 2. Мощные ингибиторы CYP3A4 следует применять с осторожностью (включая ритонавир, итраконазол, эритромицин, кларитромицин, грейпфрутовый сок).
Предварительный прием рифампицина, мощного индуктора CYP3A4, в дозе 600 мг 1 раз в сутки в течение 31 дней перед применением разовой дозы кабозантиниба, уменьшал содержание кабозантиниба в плазме крови на 77% (AUC) и увеличивал клиренс кабозантиниба в 4. Следует избегать постоянного одновременного введения мощных индукторов CYP3A4 (включая рифампицин, карбамазепин, фенитоин, фенобарбитал или лекарственные средства, содержащие зверобой (Hypericum perforatum)).
Регуляторы рН желудочно-кишечного тракта
Предварительный прием эзомепразола, ингибитора протонной помпы (ИПП), в дозе 40 мг 1 раз в сутки в течение 6 дней перед применением разовой дозы 100 мг кабозантиниба указывает на то, что это не оказывает клинически значимого влияния на содержание кабозантиниба в плазме крови (AUC). здоровых добровольцев. При одновременном введении кабозантиниба с агентами, изменяющими рН желудка, корректировка дозы не рекомендуется (включая ИПП, антагонисты рецепторов Н2 и антациды).
Ингибиторы MRP2
Данные исследований in vitro показывают, что кабозантиниб является субстратом MRP2. Поэтому введение ингибиторов MRP2 может привести к увеличению концентрации кабозантиниба в плазме.
Секвестранты желчных кислот
Секвестранты, такие как холестирамин и холестагель, могут вступать в реакцию с кабозантинибом и влиять на поглощение (или реабсорбцию), снижая неблагоприятную дозу (см. раздел «Фармакодинамика»). Клиническое значение этих потенциальных влияний неизвестно.
Воздействие кабозантиниба на другие лекарственные средства
Влияние кабозантиниба на фармакокинетику противозачаточных стероидов не исследовалось. Поскольку контрацептивный эффект не может быть гарантирован, рекомендуется использовать дополнительный метод контрацепции, в частности, барьерный.
Из-за высоких уровней связывания кабозантиниба с белками плазмы крови (см. раздел Фармакокинетика) возможно взаимодействие с варфарином – замещение протеинов плазмы. В этом случае следует контролировать показатели международного коэффициента нормализации (INR).
Ингибиторы P-гликопротеина
Кабозантиниб является ингибитором (IC50 = 7,0 mМ), но не субстратом P-гликопротеиновой (P-gp) транспортной активности в двунаправленной системе с использованием клеток, сконструированных для экспрессии Р-гликопротеина (MDCK-MDR1). Одновременное применение ингибиторов P-gp может повышать концентрацию кабозантиниба в плазме крови. Пациентов следует предупреждать о приеме лекарственных средств, которые вливают на Р-gp (таких как фексофенадин, алискирен, амбрисентан, дабигатрана этэксилат, дигоксин, колхицин, мараврик, внеконазол, ранолазин, саксаглиптин, ситаглиптин, талинолол, тол.
Особенности применения.
Поскольку большинство побочных реакций может возникать в начале лечения, необходим тщательный контроль в течение первых восьми недель лечения с целью выявления побочных реакций и повышенной индивидуальной чувствительности к лекарственному средству относительно возможной модификации дозы. События, обычно имеющие раннее начало, включают гипокальциемию, гипокалиемию, тромбоцитопению, артериальную гипертензию, синдром ладонно-подошовной эритродизестезии (СДПЭ), протеинурию и расстройства желудочно-кишечного тракта (боль в животе, воспаление слизистой).
Во время базисного клинического исследования (исследования METEOR) 59,8% и 70% пациентов с почечноклеточной карциномой после предварительного лечения средствами, влияющими на фактор роста эндотелия сосудов (VEGF), нуждались в снижении дозы и прерывании терапии вследствие побочных реакций соответственно. Для 19,3% пациентов требовалось два снижения дозы. Среднее время до первого снижения дозы составляло 55 дней, а до прерывания первой дозы – 38 дней.
У пациентов с почечноклеточной карциномой, ранее не получавших лечение, снижение дозы и прерывания терапии, проведено 46% и 73% пациентов, получавших кабозантиниб в клиническом испытании, соответственно (исследование CABOSUN).
При лечении гепатоцеллюлярной карциномы после предварительной системной терапии снижение дозы и прекращение терапии произошло у 62% и 84% пациентов, получавших кабозантиниб в клиническом испытании, соответственно (исследование CELESTIAL). Для 33% пациентов требовалось два снижения дозы. Среднее время до первого снижения дозы составляло 38 дней, а до прерывания первой дозы – 28 дней. Для пациентов с печеночной недостаточностью легкой или умеренной степени рекомендуется обеспечить более тщательный мониторинг.
Воздействие на гепатобилиарную систему
Атипичные результаты функциональных печеночных проб (повышение уровней аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и билирубина) часто наблюдаются у пациентов, получающих лечение кабозантинибом. Перед началом лечения кабозантинибом рекомендуется провести функциональные печеночные пробы (АЛТ, АСТ, билирубин) и обеспечить тщательный мониторинг этих параметров во время лечения. В случае ухудшения результатов функциональных печеночных проб в связи с лечением кабозантинибом (т.е. при отсутствии альтернативной причины) следует соблюдать рекомендации по модификации дозы, представленные в таблице 5 (см. способ применения и дозы).
Кабозантиниб выводится преимущественно печенью. Для пациентов с печеночной недостаточностью легкой или умеренной степени рекомендуется обеспечить более тщательный мониторинг общей безопасности (см. разделы «Особенности применения» и «Фармакокинетика»). Печеночная энцефалопатия на фоне лечения кабозантинибом появлялась у относительно большей доли пациентов с печеночной недостаточностью умеренной степени (В по шкале Чайлда – Пью). КАБОМЕТИКС не рекомендуется применять у пациентов с печеночной недостаточностью (С по шкале Чайлда – Пью), поскольку кабозантиниб не изучался в этой популяции, и его экспозиция может увеличиваться у этих пациентов.
Печеночная энцефалопатия
В исследовании ГЦК (исследование CELESTIAL) случаи печеночной энцефалопатии сообщали чаще в группе кабозантиниба, чем в группе плацебо. На фоне применения кабозантиниба возникала диарея, рвота, снижение аппетита и нарушение электролитного баланса. У пациентов с ГЦК и нарушением функции печени эти реакции со стороны других систем и органов могут являться предвестниками развития печеночной энцефалопатии. Рекомендуется контролировать состояние пациента на предмет признаков и симптомов печеночной энцефалопатии.
Перфорации и фистулы
При лечении кабозантинибом отмечались серьезные перфорации желудочно-кишечного тракта (ЖКТ) и фистулы, в частности с летальным исходом. Состояние пациентов с воспалительным заболеванием кишечника (например, болезнью Крона, язвенным колитом, перитонитом, дивертикулитом или аппендицитом), инфильтрацией опухоли в ЖКТ или осложнениями от предыдущей хирургии ЖКТ (особенно когда это связано с замедленным или неполным заживлением раны). началом лечения кабозантинибом и контролировать во время лечения на предмет возникновения симптомов перфораций и фистул, включая абсцессы и сепсис. Постоянная или периодическая диарея во время лечения может являться фактором риска развития фистулы прямой кишки. Лечение кабозантинибом следует полностью прекратить пациентам, у которых появилась перфорация ЖКТ или фистула, которую не удается правильно вылечить.
Со стороны желудочно-кишечного тракта (ЖКТ)
Диарея, тошнота/рвота, снижение аппетита, а также стоматит/боль в полости рта являются наиболее частыми побочными реакциями со стороны ЖКТ (см. раздел «Побочные реакции»). Для предупреждения обезвоживания, нарушения электролитного баланса и потери веса следует назначить неотложное медикаментозное лечение, в частности, поддерживающую терапию антиэметиками, противодиарейными средствами и антацидами. В случае постоянных или рецидивирующих побочных реакций со стороны ЖКТ следует рассмотреть целесообразность приостановления терапии или снижения дозы или полной отмены кабозантиниба (см. таблицу 5).
Тромбоэмболические события
Во время лечения кабозантинибом наблюдали эпизоды венозной тромбоэмболии, включая легочную эмболию и артериальную тромбоэмболию, иногда с летальным исходом. Пациентам с высоким риском появления эпизодов тромбоэмболии или пациентам с наличием этих эпизодов в анамнезе следует назначать кабозантиниб с осторожностью. В исследовании ГЦК (CELESTIAL) на фоне лечения кабозантинибом наблюдали тромбоз портальной вены, в том числе один случай с летальным исходом. Пациенты с инвазией портальной вены в анамнезе, скорее всего, испытывают больший риск развития тромбоза портальной вены. Пациентам с острым инфарктом миокарда или любым другим клинически значимым тромбоэмболическим осложнением применение кабозантиниба следует прекратить.
Кровотечения
При приеме кабозантиниба зарегистрированы случаи тяжелых кровотечений, иногда с летальным исходом. Перед началом лечения кабозантинибом состояние пациентов, у которых возникло тяжелое кровотечение, следует тщательно оценить. Пациентам с высоким риском кровотечений или пациентам группы риска кабозантиниб не следует назначать.
В исследовании ГЦК (CELESTIAL) сообщали о случаях кровотечений со смертельным исходом, которые чаще возникали на фоне применения кабозантиниба, чем плацебо. Факторы риска тяжелых кровотечений у пациентов с распространенной ГЦК могут включать инвазию опухоли в крупные кровеносные сосуды и наличие цирроза печени, что приводит к варикозу вен пищевода, портальной гипертензии и тромбоцитопении. В исследование CELESTIAL не набирали пациентов с сопутствующим лечением антикоагулянтами или антитромбоцитарными средствами. Также в это исследование не включали пациентов, которым не лечили или полностью не вылечили варикоз с кровотечениями или высоким риском кровотечения.
Тромбоцитопения
В исследовании ГЦК (CELESTIAL) сообщали о случаях тромбоцитопении и снижении уровней тромбоцитов. Во время лечения кабозантинибом следует контролировать уровни тромбоцитов и скорректировать дозировку в соответствии со степенью тяжести тромбоцитопении (см. таблицу 5).
Осложнения при заживлении ран
Зарегистрированы случаи усложнения процесса заживления ран при приеме кабозантиниба. Рекомендуется прекратить терапию кабозантинибом за 28 дней до плановой операции, включая хирургическую стоматологию, если возможно. Решение о возобновлении лечения кабозантинибом после проведения хирургических вмешательств необходимо принимать ввиду клинической оценки процесса заживления раны. Пациентам с осложнением процесса заживления ран, требующих медицинского вмешательства, лечение кабозантинибом следует прекратить.
Артериальная гипертензия
Применение кабозантиниба ассоциировалось с повышением частоты артериальной гипертензии. Перед началом лечения кабозантинибом необходимо обеспечить контроль АД. Рекомендуется мониторинг АД и лечение артериальной гипертензии в соответствии со стандартами ведения пациентов с соответствующей патологией. В случае тяжелой или стойкой артериальной гипертензии, которая сохраняется, несмотря на принятые надлежащие медицинские меры, врачу необходимо принять решение о прекращении лечения или уменьшении дозы. В случае гипертонического криза лечение кабозантинибом следует прекратить.
Синдром ладонно-подошвенной эритродизестезии (СДПЭ)
Случаи возникновения синдрома ладонно-подошвенной эритродизестезии (СДПЭ) были зарегистрированы у пациентов, получавших кабозантиниб. При тяжелом СДПЭ следует учитывать возможность прекращения лечения кабозантинибом. В случаях появления ладонно-подошвенного синдрома прием кабозантиниба следует прекратить до исчезновения симптомов или их уменьшения до 1 степени.
Протеинурия
Во время лечения кабозантинибом сообщалось о случаях возникновения протеинурии. Во время лечения кабозантинибом необходимо регулярно контролировать содержание белка в моче. Кабозантиниб следует отменить, если у пациента развивается нефротический синдром.
Синдром обратимой задней лейкоэнцефалопатии (СОЗЛ)
Случаи возникновения синдрома обратимой задней лейкоэнцефалопатии (СОЗЛ), также известного как синдром обратимой задней энцефалопатии (СОЗЭ), были зарегистрированы у пациентов, получавших кабозантиниб. СОЗЛ, что может сопровождаться судорогами, нарушением зрения, головной болью, спутанностью сознания и неврологическими расстройствами. Пациентам с СОЗЛ рекомендуется прекратить лечение кабозантинибом.
Удлинение интервала QT
Кабозантиниб рекомендуется применять с осторожностью пациентам с продлением интервала QT в анамнезе, принимающих лекарственные средства, способствующие продлению интервала QT, и пациентам с соответствующими предыдущими сердечными заболеваниями, брадикардией или нарушениями электролитного баланса. При применении кабозантиниба требуется периодический мониторинг с помощью ЭКГ и определение сывороточных концентраций калия, кальция, магния.
Атипичные результаты биохимического анализа крови
Применение кабозантиниба связано с повышенной частотой нарушения электролитного баланса (включая гипо- и гиперкалиемию, гипомагниемию, гипокальциемию, гипонатриемию). Рекомендуется контролировать параметры биохимического анализа крови при лечении кабозантинибом, а при необходимости – назначить соответствующую заместительную терапию согласно стандартам клинической практики. Случаи печеночной энцефалопатии у пациентов с ГЦК можно объяснить нарушением электролитного баланса, появляющегося на фоне лечения. Если серьезные отклонения лабораторных параметров от нормы сохраняются или периодически повторяются, следует рассмотреть целесообразность приостановки терапии, уменьшения дозы или полной отмены кабозантиниба (см. таблицу 5).
Ингибиторы и индукторы CYP3A4.
Кабозантиниб является субстратом для CYP3A4. Одновременный прием кабозантиниба и ингибитора CYРЗА4 кетоконазола может привести к выраженному увеличению экспозиции кабозантиниба. Особая осторожность требуется при применении агентов, являющихся сильными ингибиторами CYP3A4, одновременно с кабозантинибом. Одновременное применение кабозантиниба с мощными индукторами CYP3A4, например рифампицином, может уменьшать экспозицию и распределение кабозантиниба. Поэтому следует избегать сопутствующего введения агентов, являющихся сильными индукторами CYP3A4, и кабозантиниба (см. раздел «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Субстрат P-гликопротеина
Кабозантиниб является ингибитором (IC50 = 7,0 mМ), но не является субстратом P-гликопротеина (P-gp) транспортной активности в двунаправленной системе с использованием клеток, сконструированных для экспрессии Р-гликопротеина (MDCK–MDR1). Одновременное применение ингибиторов P-gp может повышать концентрацию кабозантиниба в плазме крови. Пациентов следует предупреждать о приеме лекарственных средств, влияющих на Р-gp (таких как фексофенадин, алискирен, амбрисентан, дабигатрана этексилат, дигоксин, колхицин, мараврик, внеконазол, ранолазин, саксаглиптин, ситаглиптин, талинолоз, толва. · раздел «Взаимодействие с лекарственными средствами и другие виды взаимодействий»).
Ингибиторы MRP2
Введение ингибиторов MRP2 может повышать концентрацию кабозантиниба в плазме крови. Ингибиторы MRP2 следует применять осторожно (включая циклоспорин, эфавиренз, эмтрицитабин) (см. раздел «Взаимодействие с лекарственными средствами и другие виды взаимодействий»).
Предостережения по вспомогательным веществам
Пациенты с редкой наследственной непереносимостью галактозы, дефицитом Lapp-лактазы или мальабсорбцией глюкозы-галактозы не должны принимать это лекарственное средство.
1 таблетка, покрытая плёночной оболочкой, по 20 мг – содержит 15,54 мг лактозы.
1 таблетка, покрытая плёночной оболочкой, по 40 мг – содержит 31,07 мг лактозы.
1 таблетка, покрытая плёночной оболочкой, по 60 мг – содержит 46,61 мг лактозы.
Любые остатки неиспользованного лекарственного средства или отходы следует утилизировать в соответствии со стандартами больничной практики.
Применение в период беременности или кормления грудью.
Женщины репродуктивного возраста/контрацепция для мужчин и женщин
Женщинам репродуктивного возраста во время лечения кабозантинибом следует избегать беременности. Женщины репродуктивного возраста и мужчины должны использовать эффективные методы контрацепции в течение лечения и через 4 месяца после завершения курса лечения. Поскольку пероральные контрацептивы, возможно, не будут считаться эффективными методами контрацепции, в случае их использования следует принимать другие меры предосторожности (см. раздел «Взаимодействие с лекарственными средствами и другие виды взаимодействий»).
Беременность
Данных по применению кабозантиниба беременными женщинами нет. В ходе исследований на животных была обнаружена репродуктивная токсичность. Потенциальный риск для человека неизвестен. Кабозантиниб не следует применять в течение беременности, кроме случаев клинической необходимости.
Кормление грудью
Неизвестно, попадает ли кабозантиниб или его метаболиты в грудное молоко человека. Нельзя исключать риск грудного вскармливания, поэтому во время лечения кабозантинибом и по крайней мере в течение 4 месяцев после завершения лечения необходимо прекратить грудное вскармливание.
фертильность.
Данных о влиянии кабозантиниба на фертильность человека нет. Результаты исследований указывают на то, что кабозантиниб может негативно повлиять на фертильность у мужчин и женщин. Мужчинам и женщинам необходимо использовать эффективные методы контрацепции при лечении.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Кабозантиниб оказывает незначительное влияние на способность управлять транспортными средствами или другими механизмами. Во время лечения кабозантинибом некоторые пациенты сообщали о побочных реакциях, таких как утомляемость и слабость. Во время лечения следует соблюдать осторожность при управлении автотранспортом или другими механизмами.
Способ применения и дозы.
Лечение лекарственным средством КАБОМЕТИКС должен назначать и проводить врач, имеющий опыт назначения противоопухолевых лекарственных средств.
Способ применения
Кабометикс предназначен для перорального применения. Таблетки глотают целиком, не измельчая. Пациентам не следует употреблять пищу за 2 ч до и по крайней мере 1 ч после приема лекарственного средства КАБОМЕТИКС.
Дозы
Рекомендуемая доза Кабометикса для лечения НКК и ГЦК составляет 60 мг один раз в сутки.
Лечение лекарственным средством следует продолжать до момента прекращения получения пациентом клинических преимуществ от терапии или до появления недопустимых признаков токсичности.
Возникновение подозреваемых побочных реакций на лекарственное средство может потребовать временного прекращения лечения и/или снижения дозы КАБОМЕТИКС (см. таблицу 5). В случае необходимости, дозу рекомендуется уменьшить до 40 мг/сут, а затем до 20 мг/сут.
При развитии токсичности 3 степени по классификации СТСАЭ (Единые терминологические критерии побочных реакций) или выше или при развитии непереносимой токсичности 2 степени необходимо временно приостановить лечение. При серьезных или непереносимых проявлениях токсичности рекомендуется снизить дозу.
Пропущенную дозу следует принимать, если до приема следующей дозы осталось менее 12 часов.
Таблица 5
Рекомендуемые модификации доз лекарственного средства КАБОМЕТИКС и необходимые меры при развитии побочных реакций
|
Побочная реакция и степень тяжести |
Рекомендуемые изменения дозы и мероприятия |
|
Побочные реакции 1–2 степени, хорошо переносимые и легко лечащиеся |
Не нужно корректировать дозу. Начать поддерживающую терапию по показаниям. |
|
Побочные реакции 2 степени, которые являются непереносимыми, не исчезают после снижения дозы или назначения поддерживающей терапии. |
Прекратить лечение, пока токсичность не снизится до 1 степени. Показано начать поддерживающую терапию по показаниям. Рассмотреть возможность восстановления терапии в меньшей дозе. |
|
Побочные реакции 3 степени (за исключением клинически неподходящих лабораторных отклонений) |
Прекратить лечение, пока токсичность не снизится до 1 степени. Показано начать поддерживающую терапию по показаниям. Восстановить терапию в меньшей дозе. |
|
Побочные реакции 4 степени (за исключением клинически неподходящих лабораторных отклонений) |
Приостановить лечение. Оказать соответствующую медицинскую помощь. При уменьшении токсичности до 1 степени, восстановить терапию в меньшей дозе. Если побочные реакции сохраняются, окончательно отменить лечение лекарственным средством КАБОМЕТИКС. |
Примечание: Критерии оценки степени тяжести побочных реакций согласно NCI-CTCAE v4.
Сопутствующие лекарственные средства
Следует с осторожностью сопутствовать лекарственным средствам, являющимся сильными ингибиторами СYP3A4, и следует избегать постоянного сопутствующего применения лекарственных средств, являющихся сильными индукторами CYP3A4 (см. разделы «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Следует учитывать выбор альтернативного сопутствующего лекарственного средства, не имеющего или имеющего минимальную ингибирующую активность по влиянию на изофермент CYP3A4.
Особые группы пациентов
Пациенты пожилого возраста
Не требуется корректировка дозы кабозантиниба у пациентов пожилого возраста (≥ 65 лет).
Этническая принадлежность
Этническая принадлежность не требует корректировки дозы (см. раздел Фармакокинетика).
Пациенты с почечной недостаточностью
Кабозантиниб следует назначать с осторожностью пациентам с почечной недостаточностью легкой или умеренной степени.
Кабозантиниб противопоказан пациентам с почечной недостаточностью тяжелой степени, поскольку безопасность и эффективность кабозантиниба для этой популяции больных не установлены.
Пациенты с печеночной недостаточностью
Пациентам с печеночной недостаточностью легкой степени корректировки дозы не требуется. Поскольку имеются лишь ограниченные данные о применении кабозантиниба у пациентов с печеночной недостаточностью умеренной степени (В по шкале Чайлда – Пью), невозможно дать рекомендации по дозировке. Для этих пациентов рекомендуется обеспечить мониторинг общей безопасности (см. разделы «Особенности применения» и «Фармакокинетика»). Учитывая отсутствие клинического опыта применения кабозантиниба у пациентов с печеночной недостаточностью тяжелой степени (С по шкале Чайлда – Пью), кабозантиниб не рекомендуется применять в этой категории пациентов (см. раздел «Фармакокинетика»).
Пациенты с сердечной недостаточностью
Данные по применению пациентам с сердечной недостаточностью ограничены. Не существует конкретных рекомендаций по дозировке для этой популяции пациентов.
Дети.
Безопасность и эффективность кабозантиниба для детей и подростков (<18 лет) не установлены. Соответствующие данные отсутствуют. Не использовать детям.
Передозировка.
Специального лечения при передозировке кабозантинибом не существует, а возможные симптомы передозировки не установлены. При подозрении на передозировку прием кабозантиниба следует прекратить и начать поддерживающую терапию. Необходим контроль лабораторных биохимических показателей и параметров метаболизма и мониторинг их по крайней мере еженедельно или при наличии клинических показаний. Побочные реакции, связанные с передозировкой, лечат симптоматически.
Побочные реакции.
Краткое описание профиля безопасности
Наиболее распространенными серьезными побочными реакциями у пациентов с НКК (частота ≥ 1%) являются диарея, артериальная гипертензия, обезвоживание, гипонатриемия, тошнота, снижение аппетита, эмболия, утомляемость, гипомагниемия, синдром ладонно-подошовной эритродизестезии.
Наиболее распространенными побочными реакциями любой степени (наблюдавшими по меньшей мере у 25% пациентов) среди больных НКК были диарея, артериальная гипертензия, утомляемость, повышение АСТ, повышение АЛТ, тошнота, снижение аппетита, СДПЭ, дисгевзия, снижение уровня тромбоцитов. анемия, рвота, снижение массы тела, диспепсия и закреп. Артериальную гипертензию наблюдали чаще у пациентов с НКК, ранее не получавших лечение (67%), по сравнению с больными НКК, которым ранее применяли средства, влияющие на VEGF (37%).
Наиболее распространенными серьезными побочными реакциями у пациентов с ГЦК (частота ≥ 1%) являются печеночная энцефалопатия, синдром ладонно-подошвенной эритродизестезии, астения и диарея. Наиболее распространенными побочными реакциями любой степени (наблюдавшими по меньшей мере у 25% пациентов) среди больных ГЦК были диарея, синдром ладонно-подошвенной эритродизестезии, утомляемость, снижение аппетита, артериальная гипертензия и тошнота. Список побочных реакций приведен в таблице 6.
В таблице 6 побочные реакции распределены по классам систем органов согласно терминологии MedDRA и классифицированы по частоте по данным обо всех степенях тяжести следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и < 1/10), нечасто (≥ 1/1000 и < 1/100), неизвестно (невозможно определить по имеющимся данным). В пределах каждой группы по частоте побочные реакции представлены в порядке уменьшения их серьезности.
Таблица 6
Побочные реакции на лекарственное средство (ПРЛС), зарегистрированные при применении кабозантиниба в клинических исследованиях
|
Система органов (по MedDRA) |
Очень часто |
Часто |
Нечасто |
Неизвестно |
|
Инфекции и инвазии |
абсцесс |
|||
|
Со стороны кровеносной и лимфатической систем |
анемия |
нейтропения тромбоцитопения |
лимфопения |
|
|
Со стороны органов эндокринной системы |
гипотиреоз |
|||
|
Со стороны метаболизма и пищеварительной системы |
снижение аппетита гипомагниемия гипокалиемия |
дегидратация гипоальбуминемия гипофосфатемия гипонатриемия гипокальциемия гиперкалиемия гипербилирубинемия гипергликемия гипогликемия |
||
|
Со стороны нервной системы |
дисгевзия головная боль головокружение |
периферическая сенсорная нейропатия |
судороги |
церебровас-кулярное нарушение |
|
Со стороны органов слуха и равновесия |
тинитус |
|||
|
Со стороны сердца |
инфаркт миокарда |
|||
|
Со стороны сосудистой системы |
артериальная гипертензия кровоизлияния |
венозный тромбоз артериальный тромбоз |
||
|
Со стороны дыхательной системы, органов грудной клетки и средостения. |
дисфония одышка кашель |
легочная эмболия |
||
|
Со стороны пищеварительной системы |
диарея тошнота рвота стоматит запор боли в животе диспепсия боли в верхних отделах живота |
перфорация желудочно-кишечного тракта фистула гастроэзофагальный рефлюкс геморрой боль в полости рта сухость во рту |
панкреатит глосалгия |
|
|
Со стороны гепатобилиарной системы |
печеночная энцефалопатия |
холестатический гепатит |
||
|
Со стороны кожи и подкожной клетчатки |
синдром ладонно-подошвенной эритродизес-тезии сыпь |
зуд алопеция сухость кожи акнеформный дерматит изменение цвета волос |
||
|
Со стороны скелетно-мышечной системы и соединительной ткани |
боль в конечностях |
мышечные спазмы артралгия |
остеонекроз челюсти |
|
|
Со стороны почек и мочевыводящих путей |
протеинурия |
|||
|
Общие нарушения |
утомляемость воспаления слизистых оболочек астения периферический отек |
|||
|
Со стороны лабораторных показателей |
снижение массы тела повышение уровня аланинамино-трансферазы (AЛT) в сыворотке крови повышение уровня аспартатамино-трансферазы (AСT) в сыворотке крови |
повышение уровня щелочной фосфатазы (ЛФ) в крови повышение уровня гамма-глутамилтрансферазы (ГГТ) повышение уровня креатинина в крови повышение уровня амилазы повышение уровня липазы повышение уровня холестерина в крови снижение уровней лейкоцитов |
повышение уровней триглицеридов в крови |
|
|
Травмы, отравления и осложнения, вызванные при проведении процедур |
осложнение заживления ран |
Описание отдельных побочных реакций
Данные относительно нижеследующих реакций у пациентов, принимавших лекарственное средство КАБОМЕТИКС в дозе 60 мг/сут (перорально), получены во время базисных исследований с участием пациентов с НКК после терапии на основе лекарственных средств, которые влияют на VEGF, и НКК, ранее не получали лечение, а также с участием пациентов с ГЦК после предварительной системной терапии (см. раздел Фармакодинамика).
Перфорация желудочно-кишечного тракта
В исследовании НКК после применения лекарственных средств, влияющих на VEGF (METEOR), перфорация ЖКТ степени 2 или 3 была зарегистрирована у 0,9% пациентов с почечноклеточной карциномой, получавших лечение кабозантинибом (у 3 из 331). Медиана времени до появления перфораций составляла 10 недель.
В исследовании НКК с участием пациентов, ранее не получавших лечение (CABOSUN), перфорацию ЖКТ степени 4 и 5 выявили у 2,6% (у 2 из 78) пациентов, получавших кабозантиниб.
В исследовании ГЦК (CELESTIAL) перфорацию ЖКТ степени 3 или 4 обнаружили у 0,9% пациентов, которых лечили кабозантинибом (4 из 467). Медиана времени до появления перфораций составляла 5,9 недели.
В клинической программе исследования кабозантиниба отмечались случаи перфорации с летальным исходом.
Печеночная энцефалопатия
В исследовании ГЦК (CELESTIAL) печеночную энцефалопатию (печеночную энцефалопатию, энцефалопатию, гипераммонимическую энцефалопатию) отмечали у 5,6% пациентов, получавших кабозантиниб (26 из 467). Реакции степени 3-4 наблюдали у 2,8%; также зафиксирован один случай ступени 5 (0,2%). Медиана времени до развития энцефалопатии составляла 5,9 недели. В исследованиях НКК (METEOR и CABOSUN) случаев печеночной энцефалопатии не зафиксировано.
Диарея
В исследовании НКК после предварительной терапии средствами, влияющими на VEGF (METEOR), диарею обнаружено у 74% пациентов, получавших кабозантиниб (245 из 331). Реакции степени 3 – 4 составили 11%. Медиана времени до появления диареи составляла 4,9 недели.
В исследовании НКК среди пациентов, ранее не получавших лечение (CABOSUN), диарею наблюдали у 73% пациентов, получавших кабозантиниб (57 из 78). Реакции степени 3 – 4 зафиксированы в 10% случаев.
В исследовании ГЦК (CELESTIAL) диарею наблюдали у 54% пациентов, получавших кабозантиниб (251 из 467); реакции степени 3-4 зафиксированы в 9,9%. Медиана времени до появления всех этих случаев составила 4,1 недели. В результате диареи у 84 из 467 (18%), 69 из 467 (15%) и у 5 из 467 (1%) пациентов пришлось изменять дозу, прекратить терапию и полностью отменить лечение соответственно.
Фистулы
В исследовании НКК после предварительной терапии средствами, влияющими на VEGF (METEOR), фистулы наблюдались у 1,2% (у 4 из 331) пациентов, принимавших кабозантиниб, в частности фистулы прямой кишки у 0,6% (у 2 из 331). . Один случай классифицирован как побочная реакция 3 степени, а остальной – как реакции 2 степени. Медиана времени до появления фистулы составила 30,3 недели.
В исследовании НКК с участием пациентов, ранее не получавших лечение (CABOSUN), фистулы не обнаружили.
В исследовании ГЦК (CELESTIAL) фистулы наблюдали у 1,5% (7 из 467) больных ГЦК. Медиана времени до появления фистулы составляла 14 недель.
В программе клинической разработки кабозантиниба сообщали о случаях фистул с летальным исходом.
Кровотечение
В исследовании НКК после предварительной терапии средствами, влияющими на VEGF (METEOR), частота возникновения тяжелых геморрагических событий (степень ≥ 3) составила 2,1% у пациентов с НКК, получавших кабозантиниб (7 из 331). Медиана времени до начала кровотечения составила 20,9 недель.
В исследовании НКК с участием пациентов, ранее не получавших лечение (CABOSUN), частота возникновения тяжелых геморрагических событий (степень ≥ 3) составила 5,1% (4/78) среди пациентов с НКК, получавших кабозантиниб.
В исследовании ГЦК (CELESTIAL) частота возникновения тяжелых геморрагических событий (степень ≥ 3) составила 7,3% у пациентов, получавших кабозантиниб (34 из 467). Медиана времени до начала кровотечения составляла 9,1 нед.
В программе клинической разработки кабозантиниба сообщали о случаях кровотечения со смертельным исходом.
Синдром обратимой задней лейкоэнцефалопатии (СОЗЛ)
В исследованиях METEOR, CABOSUN или CELESTIAL не было сообщений о случаях СОЗЛ, но в других клинических исследованиях изредка сообщалось о случаях СОЗЛ (у 2 из 4872 пациентов; 0,04%).
Сообщение о побочных реакциях
▼Это лекарственное средство является объектом дополнительного мониторинга.
Сообщения о побочных реакциях после регистрации лекарственного средства важны. Это обеспечивает постоянный мониторинг соотношения польза/риск лекарственного средства. Медицинских работников просят сообщать о любых подозреваемых побочных реакциях через национальную систему сообщений.
Срок годности.
3 года.
Условия хранения.
Лекарственное средство не нуждается в особых условиях хранения. Хранить в недоступном для детей месте.
Упаковка.
20 мг: по 7 таблеток, покрытых пленочной оболочкой в блистере; по 4 блистера в картонной коробке или по 30 таблеток, покрытых плёночной оболочкой в бутылке из полиэтилена высокой плотности (HDPE) с полипропиленовым средством, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиэфирным; по 1 бутылке в картонной коробке;
40 мг: по 7 таблеток, покрытых пленочной оболочкой в блистере; по 4 блистера в картонной коробке или по 30 таблеток, покрытых плёночной оболочкой в бутылке из полиэтилена высокой плотности (HDPE) с полипропиленовым средством, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиэфирным; по 1 бутылке в картонной коробке;
60 мг: по 7 таблеток, покрытых пленочной оболочкой в блистере; по 4 блистера в картонной коробке или по 30 таблеток, покрытых плёночной оболочкой в бутылке из полиэтилена высокой плотности (HDPE) с полипропиленовым средством, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиэфирным; по 1 бутылке в картонной коробке.
Категория отпуска.
По рецепту.
Производитель.
Патеон Франция/Patheon France.
Местонахождение производителя и адрес места его деятельности.
40 бульвар де Шамперт, Бургуен-Жалье, 38300, Франция/40 boulevard de Champaret, Bourgoin Jallieu, 38300, Франция.
Заявитель.
ИПСЕН ФАРМА/IPSEN PHARMA.
Местонахождение заявителя.
65, набережная Жорж Горс-92100 Булонь Бийанкур, Франция/65, quai Georges Gorse-92100 Boulogne Billancourt, France.
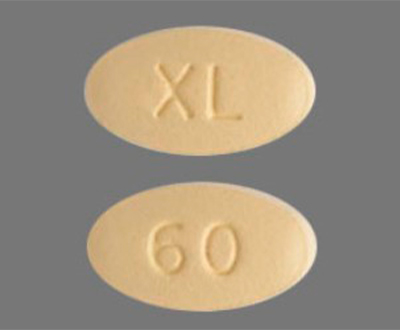
Кабометикс относят к противоопухолевым средствам, которые созданы для борьбы с онкологией. Препарат выпускают в форме таблеток с разной дозировкой — 20, 40 и 60 мг. Они имеют желтый цвет, круглую форму, надписи «XL» и указанное количество действующего вещества с двух сторон. Таблетки упаковывают в блистеры. В коробке находится 30 штук.
Одна таблетка Кабометикса содержит кабозантиниб (S)-малат, целлюлозу, лактозу, магния стеарат, краситель Е172 и другие компоненты. Принимают перорально, запивая водой и не разжевывая. Страна производитель — Канада.
Для чего нужен Кабометикс
Таблетки Cabometyx 40 mg применяют для лечения распространенной почечно-клеточной опухоли. Как правило, пациенты ранее не получали терапию, использовали антиангиогенные препараты, имели промежуточный или плохой прогноз.
Противопоказания
Основными противопоказаниями для использования препарата являются:
- беременность;
- период лактации;
- возраст до 18 лет;
- заболевания печени и почек с тяжелым течением.
При тромбоэмболии, осложнениях после хирургических вмешательств, болезнях ЖКТ, брадикардии Кабометикс применяют с осторожностью и тщательно отслеживают состояние пациента.
Препарат можно использовать одновременно с другими лекарствами — ингибиторами CYP3A4, MRP2, антиаритмическими средствами.

Как принимать Кабометикс
Cabometyx 60 mg (от 1 до 3 таблеток) принимают один раз в сутки. Желательно пить лекарство в одно и то же время, например, утром, в обед или вечером.
Лечение следует продолжать, пока есть эффект от получаемой терапии или не развилась неприемлемая токсичность.
Обратите внимание! Режим дозирования зависит от количества основного вещества в препарате. Рекомендуемую дозу устанавливает врач.
Побочные действия
Реакции чаще всего возникают в начале лечения, поэтому в первые 8 недель приема препарата врач должен отслеживать любые изменения в состоянии пациента.
На фоне лечения Кабометиксом могут возникать:
- боли в конечностях;
- спазмы в мышцах;
- тошнота;
- рвота;
- головокружение;
- стоматит;
- запор;
- кашель;
- протеинурия;
- шум в ушах;
- инфаркт миокарда;
- гипотериоз;
- анемия.
Также отмечают потерю веса и появление слабости.
Где купить Кабометикс
Заказать Кабометикс можно в онлайн-аптеке «Аптека Life». Препарат отпускается строго по рецепту. Оплатить заказ можно банковской картой, наличными или переводом на расчетный счет. Мы доставляем лекарства по Украине любой почтовой службой, а по Киеву, Черкассам и Харькову — курьером. Также возможен самовывоз.


