Где купить КСТАНДИ капсулы 40мг №112 спец. стоимость "Червона калина" (при покупке 2-ух упаковок одномоментно).
Аптека
ФАРМАСФЕРА №2
Пн - Пт с 08.00 до 20.00
Сб-Вс с 08.00 до 18.00
без выходных
Аптека
ФАРМАСФЕРА №3
Аптека 7Я №1
Аптека №3 ТОВ "7Я+"
Пн - Пт с 08.00 до 19.00
Сб с 08.00 до 16.00
Вс - выходной
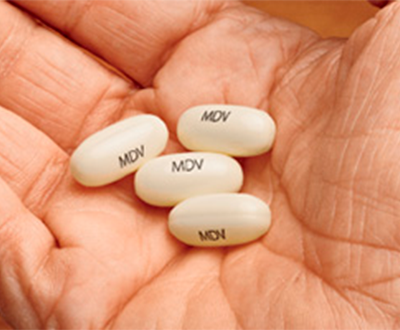
Кстанди – это антиандроген, противоопухолевое средство. Его применяют у онкологических больных. Лекарство позволяет уменьшить опухоль предстательной железы. Страна производитель – США.
Форма выпуска и состав
Лекарство Кстанди выпускается в капсулах. Они имеют продолговатую форму. Капсулы непрозрачные, могут быть белого или желтоватого цвета. Желатиновая оболочка полностью заполняется жидкостью. На одной стороне есть надпись «ENZ».
Средство упаковывают в блистеры из фольги. В пластинке есть 28 штук, а в упаковке – 112 капсул.
Одна таблетка содержит 40 мг энзалутамида. Эта жидкость практически не растворяется в воде, легко всасывается в ткани, абсорбируется.
В качестве вспомогательных веществ используют черные чернила, желатин, глицерол, очищенную воду и другие составляющие.
Применение
Препарат Xtandi имеет только одно показание к применению – лечение рака предстательной железы с метастазами. Пьют 4 капсулы (160 мг) 1 раз в день. Таблетки не разжевывают, запивают водой. Время приема пищи не учитывается, но желательно пить капсулы в одинаковое время суток.
Обратите внимание! Дозировку должен назначать врач. В случае возникновения побочных эффектов следует снизить дозировку или прекратить прием лекарства на неделю.
Если пациент одновременно принимает ингибиторы CYP2C8, то дозу Кстанди сокращают вдвое – до 80 мг/сутки.
Противопоказания к приему
Лекарственное средство не назначают женщинам и детям. Также прием таблеток Xtandi категорически запрещен при гиперчувствительности к действующему веществу.
С осторожностью препарат применяют у людей с:
- недостаточностью почечной и печеночной;
- риском развития судорог и удлинения интервала QT;
- непереносимостью фруктозы;
- инфарктом миокарда в анамнезе;
- курсом лечения онкологии, который включает применения доциклава.
Также капсулы не пьют при синдроме задней обратимой энцефалопатии.
Побочные эффекты
Препарат Кстанди часто вызывает чувство страха, головную боль, приливы, усталость и астенический синдром. Среди других побочных эффектов выделяют:
- отек языка, губ, глотки;
- галлюцинации;
- ухудшение и потерю памяти;
- судороги;
- синдром беспокойных ног;
- сухость кожи и зуд;
- тошноту;
- рвоту;
- гипертензию;
- нарушение внимания.
Если появился хотя бы один или несколько подобных симптомов, об этом нужно сказать врачу.
Принцип действия Xtandi
Опухоль предстательной железы гормонозависимая. Тестостерон стимулирует разрастание тканей простаты и преобразуется в дигидротестостерон (ДГТ). Сократить его выработку можно только путем кастрации. Но тестостерон также вырабатывается надпочечниками, поэтому его производство не прекращается полностью.
Когда даже минимальная доза ДГТ воздействует на рецепторы андрогенов, опухоль развивается. Чтобы это прекратить, нужно использовать антиандрогены, к которым относится Кстанди 40 мг.
Принцип действия препарата основывается на подавлении андрогенных рецепторов тремя способами:
- ингибирование связывания тестостерона;
- блокирование транслокацию в ядро;
- препятствование связывания с ДНК.
В результате опухоль уменьшается, а в некоторых случаях можно добиться полной ремиссии.
Как купить Кстанди 40 мг
Заказать Xtandi 40 мг можно в онлайн аптеке «Аптека Life». Чтобы оформить покупку, нужно:
- зайти на сайт и выбрать нужный препарат;
- добавить его в корзину;
- ввести ФИО, способ доставки и оплаты, точный адрес.
При необходимости можно обратиться за помощью к менеджерам. Они уточнят ваши данные и самостоятельно оформят заказ.
Мы принимаем оплату банковской картой, наличными или безналичным расчетом. Доставка осуществляется по всей Украине почтовыми службами, а по Киеву, Харькову и Черкассам – курьером. Возможен самовывоз.
діюча речовина: enzalutamide;
1 капсула містить ензалутаміду 40 мг;
допоміжні речовини: каприлокапроїлмакроголгліцериди, бутилгідроксіанізол (Е 320), бутилгідрокситолуол (Е 321), оболонка: желатин, сорбіто-сорбітановий розчин, гліцерин, титану діоксид (Е 171), чорнило для друку.
Лікарська форма
Капсули.
Основні фізико-хімічні властивості: капсули м’які, непрозорі, продовгуватої форми, білого або майже білого кольору, з маркуванням «ENZ» чорного кольору.
Фармакотерапевтична група
Антиандрогени. Код АТХ L02B B04.
Фармакологічні властивості
Фармакодинаміка.
Механізм дії.
Розвиток злоякісної пухлини передміхурової залози залежить від наявності андрогенів і реагує на пригнічення активності андрогенних рецепторів на клітинах пухлини. Незважаючи на низькі чи дуже низькі рівні андрогенів в плазмі крові, що не визначаються, активність андрогенних рецепторів на клітинах пухлини продовжує сприяти прогресуванню хвороби. Стимуляція росту пухлинних клітин за допомогою андрогенних рецепторів вимагає їх транслокації в ядро клітини і зв’язування з ДНК. Ензалутамід є потужним інгібітором андрогенних рецепторів, який блокує декілька етапів сигнального шляху андрогенних рецепторів. Ензалутамід конкурентно інгібує зв’язування андрогенів з андрогенними рецепторами, пригнічує ядерну транслокацію активованих рецепторів і пригнічує зв’язування активованих рецепторів андрогенів з ДНК, навіть в умовах надлишкової експресії андрогенних рецепторів і в клітинах пухлини, резистентних до антиандрогенів. Лікування ензалутамідом пригнічує ріст клітин пухлини передміхурової залози і може індукувати загибель клітин і регресію пухлини. В ході доклінічних досліджень у ензалутаміду була відсутня активність агоніста андрогенних рецепторів.
Фармакодинамічні властивості.
В ході 3 фази клінічного дослідження (AFFIRM) за участю пацієнтів після неефективної хіміотерапії доцетакселом у 54% пацієнтів, які отримували ензалутамід, порівняно з 1,5% пацієнтів, які отримували плацебо, спостерігалось щонайменше 50-відсоткове зниження рівня простатичного специфічного антигену (ПСА) порівняно з вихідним рівнем.
В ході 3 фази іншого клінічного випробування (PREVAIL) за участю пацієнтів, що не отримували раніше хіміотерапію, у хворих, які приймали ензалутамід, був продемонстрований значно вищий показник зниження ПСА (визначається як ≥ 50% зниження порівняно з вихідним рівнем), ніж у пацієнтів, які приймали плацебо: 78,0% проти 3,5% (різниця – 74,5%, р < 0,0001).
В ході II фази клінічного випробування (TERRAIN) за участю пацієнтів, що не отримували раніше хіміотерапію, у хворих, які приймали ензалутамід, був продемонстрований значно вищий показник зниження ПСА (визначається як ≥ 50% зниження порівняно з вихідним рівнем), ніж у пацієнтів, які приймали бікалутамід: 82,1% проти 20,9% (різниця – 61,2%, р < 0,0001).
У дослідженні (9785-CL-0410) за участю пацієнтів, які раніше отримували протягом не менше 24 тижнів абіратерон (плюс преднізолон), у 22,4% пацієнтів було зареєстровано ≥ 50% зниження рівня ПСА порівняно з вихідним рівнем. Відповідно до попереднього анамнезу хіміотерапії, частка пацієнтів зі зниженням рівня ПСА ≥ 50% була 22,1% і 23,2% у групі без попередньої хіміотерапії і групі застосування хіміотерапії відповідно.
Клінічна ефективність і безпека
Ефективність ензалутаміду була встановлена у двох рандомізованих, плацебо-контрольованих, багатоцентрових клінічних дослідженнях 3 фази [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)] у пацієнтів із прогресуванням метастатичного раку передміхурової залози на фоні невдалої андрогендеприваційної терапії (при застосуванні аналога лютеїнізуючого гормону рилізинг-гормону (ЛГРГ) або після білатеральної орхіектомії). В дослідженні PREVAIL брали участь пацієнти, які не отримували лікування із застосуванням хіміотерапії; а в дослідженні AFFIRM брали участь пацієнти, які отримували до цього доцетаксел. Всі пацієнти продовжували застосувати аналоги ЛГРГ або перенесли білатеральну орхіектомію. В досліджуваній групі лікарський засіб Кстанді застосовувався перорально в дозі 160 мг на добу. В обох клінічних дослідженнях пацієнти отримували плацебо в контрольній групі; пацієнтам також дозволялось, але не вимагалось застосування преднізолону (максимальна допустима добова доза преднізолону 10 мг чи еквівалентна доза).
Зміни рівня ПСА не завжди визначають клінічну ефективність. Таким чином, в обох дослідженнях було рекомендовано, щоб пацієнти продовжували приймати призначену терапію до появи у них симптомів, що відповідають критеріям вибування з дослідження, як зазначається нижче для кожного дослідження.
Дослідження MDV3100-03 (PREVAIL)(пацієнти, які не отримували хіміотерапію)
Загалом 1717 пацієнтів без симптомів або з помірно вираженими симптомами були рандомізовані 1:1 в групи ензалутаміду в дозі 160 мг 1 раз на добу (N = 872) або плацебо 1 раз на добу (N = 845). В дослідження включалися пацієнти з вісцеральними метастазами, з наявністю помірно вираженої та вираженої серцевої недостатності [клас І або ІІ хронічної серцевої недостатності за функціональною класифікацією Нью-Йоркської Асоціації Кардіологів (NYHA)] в анамнезі, та пацієнти, які приймали препарати, що можуть знижувати судомний поріг. З дослідження виключалися пацієнти з судомами в анамнезі або станом, що може сприяти виникненню судом, та пацієнти з помірним або вираженим болем, викликаним раком передміхурової залози. Лікування в дослідженні продовжувалося до прогресування захворювання (наявність радіографічної прогресії, ускладнення з боку кісток або клінічного прогресування) і початку або цитотоксичної терапії, або лікування іншим досліджуваним препаратом чи до розвитку непереносимої токсичності.
Дані пацієнтів та вихідні характеристики захворювання були збалансовані між групами лікування. Середній вік становив 71 рік (42–93 роки). Серед пацієнтів європейці становили 77%, азіати – 10%, афроамериканці – 2%, представники інших рас – 11%. У 68% відмічався бал 0 за шкалою оцінки життєдіяльності ECOG, та у 32% пацієнтів відмічався бал 1 за шкалою ECOG.
У 67% пацієнтів вихідна оцінка болю складала 0–1 (відсутність симптомів), а у 32% пацієнтів – 2–3 (помірні симптоми) при оцінці згідно з коротким питальником щодо оцінки болю (скорочена форма) (посилення болю за минулі 24 години за шкалою від 0 до 10). Приблизно у 45% пацієнтів на початку дослідження відмічалися захворювання м’яких тканин, а у 12% пацієнтів відмічалися вісцеральні (легені та/або печінка) метастази. Складеними первинними точками були загальна виживаність та виживаність без радіографічної прогресії (рБПВ). В доповнення до первинних точок ефективність оцінювалась за часом до початку цитотоксичної хіміотерапії, загальною відповіддю з боку м’яких тканин, часом до першого кісткового ускладнення, ПСА-відповіддю (зниження ≥ 50% від вихідного рівня), періодом прогресії за рівнем ПСА та періодом погіршення загального бала за шкалою FACT-P.
Радіографічна прогресія оцінювалася при послідовних променевих обстеженнях з використанням критеріїв PCWG2 (для кісткових уражень) та/або RECIST v1.1 (при ураженні м’яких тканин). При оцінці рБПВ використовувалася централізована оцінка радіографічної прогресії.
Аналіз рБПВ, що використовувався централізовано при оцінці радіографічної прогресії.
У проміжному аналізі загальної виживаності при смерті 540 пацієнтів було показано, що при лікуванні ензалутамідом відмічалося статистично достовірне збільшення загальної виживаності в порівнянні з плацебо зі зниженням ризику смерті на 29,4% [співвідношення ризиків (СР) = 0,706 (95% ДІ: 0,596; 0,837), р<0,0001]. Оновлений аналіз проводився при наявності 784 смертельних випадків. Результати оновленого аналізу виживаності (середній період виживання становив 35,3 та 31,3 місяця відповідно [СР = 0,77 (95% ДІ: 0,67; 0,88), р = 0,0002]) відповідали даним проміжного аналізу (середній період виживаності становив 32,4 та 30,2 місяця відповідно [СР = 0,71 (95% ДІ: 0,60; 0,84), р<0,00041]).
В оновленому аналізі 52 % пацієнтів, які приймали ензалутамід, та 81% пацієнтів, які приймали плацебо, проходили лікування метастатичного кастраційно-резистентного раку передміхурової залози, що може подовжувати період загальної виживаності.
У запланованому аналізі рБПВ відмічалося статистично достовірне покращення у групах лікування зі зниженням ризику радіографічної прогресії або смерті на 81,4% в групі ензалутаміду [СР = 0,186 (95% ДІ: 0,149; 0,231), р<0,0001]. Прогресія відмічалася у 118 (14%) пацієнтів в групі ензалутаміду та у 321 (40%) пацієнтів в групі плацебо. Медіана рБПВ не була досягнута (95% ДІ: 3,7; 5,4) в групі плацебо. Однакове покращення рБПВ відмічалося у всіх раніше визначених підгрупах пацієнтів (вік, вихідний статус ECOG, вихідний рівень ПСА та ЛДГ, бал Глісона на момент діагнозу, захворювання внутрішніх органів при скринінгу). У запланованому аналізі рБПВ під час спостереження було показано статистично достовірне покращення у групах лікування зі зниженим ризиком радіографічної прогресії або смерті на 69,3% в групі ензалутаміду [СР = 0,307 (95% ДІ: 0,267; 0,353), р<0,0001]. Медіана рБПВ складала 19,7 місяця в групі ензалутаміду та 5,4 місяця в групі плацебо.
В доповнення до складених первинних показників ефективності статистично достовірне покращення відмічалося за такими проспективно визначеними кінцевими точками.
Медіана часу до початку цитотоксичної хіміотерапії складала 28,0 місяця в групі ензалутаміду та 10,8 місяця в групі плацебо [СР = 0,350; (95% ДІ: 0,303; 0,403), р<0,0001].
Пацієнти з групи ензалутаміду із визначеним захворюванням та наявною об’єктивною відповіддю з боку м’яких тканин становили 58,8% (95% ДІ: 53,8; 63,7) в порівнянні з 5% (95% ДІ: 3,0; 7,7) пацієнтів групи плацебо. Абсолютна відмінність в об’єктивній відповіді з боку м’яких тканин між пацієнтами групи ензалутаміду і плацебо складала 53,9% [(95% ДІ: 48,5; 59,1), р<0,0001]. Повна відповідь відмічалася у 19,7% пацієнтів в групі ензалутаміду в порівнянні з 1,0% пацієнтів в групі плацебо, а часткова відповідь відмічалася у 39,1% пацієнтів в групі ензалутаміду проти 3,9% пацієнтів в групі плацебо.
Ензалутамід достовірно знижує ризик першого ускладнення з боку кісток на 28% [СР = 0,718 (95% ДІ: 0,610; 0,844), р<0,0001]. Ускладнення з боку кісток визначається як променева терапія або хірургія на кісткових тканинах в зв’язку з раком передміхурової залози, патологічний перелом кісток, здавлення кісткового мозку або зміна протипухлинної терапії для лікування болю в кістках. Аналіз включав 587 ускладнень з боку кісток, з яких 389 випадків (66,3%) – внаслідок променевої терапії, 79 випадків (13,5%) – здавлення спинного мозку, 70 випадків (11,9%) – патологічний кістковий перелом, 45 випадків (7,6%) – зміна протипухлинної терапії для лікування болю в кістках, 22 випадки (3,7%) – хірургія на кістковій тканині.
У пацієнтів, які отримували ензалутамід, відмічалася достовірно більш висока ПСА-відповідь (визначалася як зниження ≥ 50% від вихідного рівня) в порівнянні з пацієнтами, які отримували плацебо: 78% проти 3,5% (відмінність = 74,5%, р < 0,0001).
Медіана часу до прогресії за рівнем ПСА згідно з критеріями PCWG2 складала 11,2 місяця у пацієнтів з групи ензалутаміду та 2,8 місяця – у пацієнтів групи плацебо [СР = 0,169 (95% ДІ: 0,147; 0,195), р<0,0001].
Лікування ензалутамідом знижувало ризик погіршення за шкалою FACT-P на 37,5% в порівнянні з плацебо (р < 0,001). Медіана часу до погіршення за шкалою FACT-P складала 11,3 місяця в групі ензалутаміду та 5,6 місяця в групі плацебо.
Дослідження CRPC2 (AFFIRM) (пацієнти, які отримували хіміотерапію)
Ефективність та безпека ензалутаміду у пацієнтів з метастатичним кастраційно-резистентним раком передміхурової залози, які отримували доцетаксел та яким проводили орхіектомію, оцінювалась в рандомізованому плацебо-контрольованому, багатоцентровому клінічному дослідженні 3 фази. 1199 пацієнтів були рандомізовані 2 : 1 в групи застосування ензалутаміду в дозі 160 мг 1 раз на добу (N = 800) або плацебо 1 раз на добу (N = 399). Пацієнти могли приймати преднізолон, але це не було обов’язковим (максимальна щоденна доза преднізолону або еквівалентна доза складала 10 мг). Пацієнти, рандомізовані в кожну групу, продовжували лікування до прогресування захворювання (наявність радіографічної прогресії або поява кісткового ускладнення) та початку нової системної протипухлинної терапії або до розвитку непереносимої токсичності чи вибування.
Дані пацієнтів та вихідні характеристики захворювання були збалансовані між групами лікування. Середній вік становив 69 років (41–92 роки). 93% пацієнтів становили європейці, 4% – афроамериканці, 1% – азіати та 2% – представники інших рас. У 91,5% пацієнтів відмічався бал за шкалою оцінки життєдіяльності ECOG 0–1, а 8,5% пацієнтів мали бал 2 за шкалою ECOG; у 28% пацієнтів бал за оцінкою короткого питальника щодо виникнення болю (скорочена форма) був ≥ 4 (пацієнтами відмічено посилення болю за минулі 24 години, що визначався протягом 7 днів до рандомізації). У більшості пацієнтів (91%) відмічалися метастази в кістки, а у 23% – вісцеральні пошкодження легень та/або печінки. При включенні в дослідження у 41% пацієнтів була прогресія тільки за рівнем ПСА, тоді як у 59% пацієнтів відмічалася прогресія за рентгенологічними даними. При включенні в дослідження 51% пацієнтів отримували біфосфонати.
З дослідження AFFIRM виключалися пацієнти з медичними станами, що могли сприяти виникненню судом (див. розділ «Побічні реакції»), пацієнти, які приймали препарати, що можуть знижувати судомний поріг, а також пацієнти з клінічно вираженими серцево-судинними захворюваннями, такими як безконтрольна гіпертензія, інфаркт міокарда або нестабільна стенокардія в минулому, серцева недостатність (клас NYHA ІІІ або IV при відсутності фракції викиду ≥ 45%), клінічно виражена шлуночкова аритмія або АВ-блокада при відсутності постійного водія ритму).
В дослідженні відмічалася статистично клінічно значима перевага для пацієнтів, які приймали ензалутамід, в порівнянні з пацієнтами, які приймали плацебо (медіана періоду виживаності становила 18,4 та 13,6 місяця відповідно), [СР = 0,631 (95% ДІ: 0,529; 0,752), р<0,0001].
В доповнення до покращення загальної виживаності, що відмічалася, на користь ензалутаміду свідчать і ключові другорядні критерії оцінки (ПСА-прогресія, радіографічна виживаність без прогресування захворювання та час до першого ускладнення з боку кісткової тканини), значення яких статистично значимо відрізнялося від таких при застосуванні плацебо.
Зниження ПСА на 50% чи 90% відмічалося в 54% та 24,8% пацієнтів, які застосовували ензалутамід, та в 1,5% та 0,9% пацієнтів, які отримували плацебо (р < 0,0001). Середній час прогресування за рівнем ПСА становив 8,3 місяці у пацієнтів, які отримували ензалутамід, та 3 місяці – у пацієнтів, які отримували плацебо (р < 0,0001).
Радіографічна виживаність без прогресування (оцінка дослідників з використанням критеріїв оцінки відповіді солідних пухлин на терапію (RESICT), версія 1.1, для м’яких тканин або поява 2 або більше уражень кісток на остеосцинтиграфії) складала 8,3 місяця у пацієнтів, які отримували ензалутамід, та 2,9 місяця у пацієнтів, які отримували плацебо [СР = 0,404 (95% ДІ: 0,350; 0,466), р < 0,0001]. Аналіз включав 216 випадків смерті без документального підтвердження прогресування хвороби та 645 випадків документально підтвердженого прогресування, 303 з яких (47%) були пов’язані з м’якими тканинами, 268 (42%) були обумовлені прогресуванням кісткових метастазів та 74 (11%) були зв’язані з ураженням м’яких та кісткової тканин.
Медіана часу до появи першого ускладнення з боку кісток становила 16,7 місяця у пацієнтів, які отримували ензалутамід, та 13,3 місяця у пацієнтів, які отримували плацебо [СР = 0,688 (95% ДІ: 0,566; 0,835), р<0,0001). Ускладнення з боку кісток визначалося при променевій терапії або хірургічному втручанні на кісткових тканинах, при наявності патологічного перелому кісток, компресії спинного мозку або зміні протипухлинної терапії для лікування болю в кістках. Аналіз включав 448 ускладнень з боку кісток, 227 з яких (62%) – променева терапія кісток, 95 (21%) – компресія спинного мозку, 47 (10%) – патологічні переломи кісток, 36 (8%) – зміна протипухлинної терапії для лікування болю в кістках та 7 (2%) – оперативне втручання на кістці.
Дослідження 9785-CL-0410 (ензалутамід після абіратерону у пацієнтів з метастатичною карциномою передміхурової залози)
В дослідження було включено 214 пацієнтів з прогресуючою метастатичною карциномою передміхурової залози, які отримували ензалутамід (160 мг один раз на день) після того, як пройшли курс лікування тривалістю щонайменше 24 тижні із застосуванням абіратерону ацетату плюс преднізолон. Медіана часу виживання без прогресування рентгенологічних симптомів (первинна кінцева точка дослідження) становила 8,1 місяця (95% ДІ: 6,1; 8,3). Медіана OS не була досягнута. Відповідь ПСА (визначається як ≥ 50% зменшення порівняно з вихідним) відмічалось у 22,4% пацієнтів (95% ДІ: 17,0; 28,6).
Для 145 пацієнтів, які раніше отримували хіміотерапію, медіанна часу виживання без прогресування рентгенологічних симптомів становила 7,9 місяця (95% ДІ: 5,5; 10,8). Відповідь ПСА відмічалось у 23,2% пацієнтів (95% ДІ: 13,9; 34,9).
Для 69 пацієнтів, які раніше не отримували хіміотерапію, медіана часу виживання без прогресування рентгенологічних симптомів становила 8,1 місяця (95% ДІ: 5,7; 8,3). Відповідь ПСА відмічалось у 22,1% пацієнтів (95% ДІ: 15,6; 29,7).
У деяких пацієнтів було зареєстровано обмежену відповідь на лікування ензалутамідом після абіратерону, хоча причина цього факту на сьогодні невідома. Дизайн дослідження не дав змоги ідентифікувати ні пацієнтів, яким лікування може принести користь, ні порядок, в якому ензалутамід та абіратерон потрібно послідовно застосовувати для досягнення оптимальних результатів.
Пацієнти літнього віку.
З 1671 пацієнта, які отримували ензалутамід в дослідженнях 3 фази, 1261 пацієнт (75%) віком від 65 років, у т.ч. 516 пацієнтів (31%) були віком понад 75 років. У даних пацієнтів літнього віку та більш молодих пацієнтів не відмічалося жодних відмінностей щодо безпеки та ефективності ензалутаміду.
Фармакокінетика.
Ензалутамід погано розчиняється у воді. Розчинність даного препарату збільшена завдяки використанню каприлокапроїлмакроголгліцеридів та емульгатора/сурфактанта. В доклінічних дослідженнях абсорбція ензалутаміду збільшувалася при розчиненні в каприлокапроїлмакрогліцеридах.
Фармакокінетика ензалутаміду вивчалась у пацієнтів з раком передміхурової залози та у здорових добровольців. Середній період напіввиведення (T1/2) ензалутаміду у пацієнтів після однократного перорального прийому складає 5,8 доби (від 2,8 до 10,2 доби), а рівноважна концентрація досягається приблизно через місяць. При щоденному пероральному застосуванні ензалутамід кумулюється приблизно у 8,3 раза швидше, ніж при застосуванні разової дози. Добові коливання концентрації в плазмі крові незначні (відношення піка до мінімуму 1,25). Виведення ензалутаміду головним чином здійснюється шляхом печінкового метаболізму з утворенням активного метаболіту, який є таким же активним, як і ензалутамід, і циркулює в плазмі крові приблизно в тій же концентрації, що й ензалутамід.
Абсорбція
Максимальна концентрація в плазмі (Сmax) ензалутаміду у пацієнтів відмічалась через 1–2 години після прийому. За даними вивчення балансу маси у людей, всмоктування при пероральному прийомі ензалутаміду оцінювалось щонайменше на рівні 84,2%. Ензалутамід не є субстратом ефлюксних транспортерів Р-глікопротеїнів або білка резистентності раку молочної залози (BCRP). Стабільний рівень, середнє значення (Сmax) ензалутаміду та його активного метаболіту складає 16,6 мкг/мл (коефіцієнт варіації (CV) 23%) та 12, 7 мкг/мл (CV 30%) відповідно.
Прийом їжі не виявляє значного впливу на ступінь всмоктування ензалутаміду. В ході клінічних досліджень лікарський засіб Кстанді застосовувався незалежно від прийому їжі.
Розподіл
Середній об’єм розподілу ензалутаміду у пацієнтів після однократного перорального прийому складає 110 л. Об’єм розподілу ензалутаміду більший, ніж об’єм загальної кількості рідини в організмі, що вказує на активний розподіл в периферичних тканинах. Дослідження на тваринах показали, що ензалутамід та його активний метаболіт може проникати через гематоенцефалічний бар’єр.
Ензалутамід на 97–98% зв’язується з білками плазми крові, в першу чергу з альбуміном. Активний метаболіт зв’язується з білками плазми на 95%. В дослідженнях in vitro не відмічалося заміщення зв’язування з білками плазми між ензалутамідом та іншими лікарськими засобами із високою зв’язуючою здатністю (варфарин, ібупрофен та саліцилова кислота).
Метаболізм
Ензалутамід активно метаболізується. В плазмі крові людини присутні два основних метаболіти: N-десметилензалутамід (активний) і похідна сполука карбонової кислоти (неактивний). Ензалутамід метаболізується ферментами CYP2C8 і меншою мірою CYP3A4/5, які відіграють важливу роль у формуванні активного метаболіту (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). В дослідженні in vitro N-десметилензалутамід метаболізується до метаболіту карбонової кислоти за рахунок карбоксіестерази 1, яка також відіграє невелику роль в метаболізмі ензалутаміду до метаболіту карбонової кислоти. N-десметилензалутамід не метаболізувався ферментами CYP in vitro.
В умовах клінічного застосування ензалутамід є сильним індуктором ферменту CYP3A4, помірним індуктором ферментів CYP2C9 та CYP2C19 і не має клінічно значимого впливу на фермент CYP2C8 (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Виведення
Середній кліренс ензалутаміду у пацієнтів становить від 0,520 до 0,564 л/год.
При пероральному прийомі міченого 14C-ензалутаміду на 77-й день після введення виводилось 84,6% радіоактивної дози: 71% виводився нирками (в першу чергу як неактивний метаболіт з незначною кількістю ензалутаміду та активного метаболіту) і 13,6% виводилося через кишечник (0,39% дози ензалутаміду в незміненому вигляді).
Дані лабораторних досліджень показують, що ензалутамід не є субстратом для OATP1B1, OATP1B3 або ОСТ1 та N-десметилензалутамід не є субстратом для Р-глікопротеїну та BCRP.
За даними лабораторних досліджень ензалутамід та його основні метаболіти не інгібують такі транспортери при клінічно значимих концентраціях: OATP1B1, OATP1B3, ОСТ2 або ОАТ1.
Лінійність
В діапазоні доз від 40 до 160 мг не відмічалося серйозних відхилень від пропорційності дози. Значення стабільного рівня Сmin ензалутаміду та його активного метаболіту у окремих пацієнтів залишалися незміненими протягом 1 року тривалої терапії, демонструючи тимчасову лінійну фармакокінетику після досягнення стабільного рівня концентрації.
Ниркова недостатність
Дослідження щодо застосування ензалутаміду пацієнтам з нирковою недостатністю не проводились. З клінічних досліджень виключались пацієнти з рівнем сироваткового креатиніну > 177 мкмоль/л (2 мг/дл). Згідно з популяційним аналізом фармакокінетики, для пацієнтів зі значенням кліренсу креатиніну > 30 мл/хв (за формулою Кокрофта та Голта) корекція дози не потрібна. Ефективність ензалутаміду не вивчалась у пацієнтів з тяжкою нирковою недостатністю (кліренс креатиніну < 30 мл/хв) або термінальною стадією ниркової недостатності, тому при лікуванні таких пацієнтів слід дотримуватись обережності. Малоймовірно, що ензалутамід буде виводитися значною мірою за допомогою інтермітуючого гемодіалізу або постійного амбулаторного перитонеального діалізу.
Печінкова недостатність
Печінкова недостатність не має значного впливу на концентрацію ензалутаміду або його активного метаболіту. Однак період напіввиведення лікарського засобу був у 2 рази більше у пацієнтів із тяжкою печінковою недостатністю в порівнянні зі здоровими добровольцями (10,4 дня порівняно із 4,7 дня), що, можливо, пов’язано з підвищеним розподілом у тканинах.
Фармакокінетика ензалутаміду вивчалась у пацієнтів із вихідною печінковою недостатністю легкого ступеня (N = 6), печінковою недостатністю середнього ступеня (N = 8) або тяжкого ступеня (N = 8) (класи А, В та С за шкалою Чайлда – П’ю відповідно) та у 22 пацієнтів з контрольної групи з нормальною функцією печінки. Після однократного перорального прийому ензалутаміду в дозі 160 мг значення AUC і Сmax ензалутаміду у пацієнтів з печінковою недостатністю легкого ступеня збільшувались на 5% і 24% відповідно, значення AUC і Сmax ензалутаміду у пацієнтів з порушеннями середнього ступеня тяжкості збільшувались на 29% і знижувались на 11% відповідно, а значення AUC і Сmax ензалутаміду у пацієнтів з печінковою недостатністю тяжкого ступеня збільшувалось на 5% та знижувались на 41% відповідно, порівняно із контрольною групою. AUC і Сmax незв’язаного ензалутаміду та незв’язаних активних метаболітів у пацієнтів з печінковою недостатністю легкого ступеня підвищувалися на 14% та 19% відповідно, AUC і Сmax у пацієнтів з печінковою недостатністю середнього ступеня тяжкості підвищувалися на 14% та знижувалися на 17% відповідно, AUC і Сmax у пацієнтів з печінковою недостатністю тяжкого ступеня підвищувалися на 34% та знижувалися на 27% відповідно, порівняно із контрольною групою.
Раса
Більшість пацієнтів, що брали участь в клінічних дослідженнях (> 84%), були європейцями. За даними дослідження фармакокінетики у пацієнтів з раком передміхурової залози у Японії, клінічно значимих відмінностей у фармакокінетиці між європейцями та японцями не спостерігалося. Даних для оцінки потенційних відмінностей фармакокінетики ензалутаміду залежно від раси пацієнтів недостатньо.
Пацієнти літнього віку.
Не відмічався клінічно значимий вплив віку на фармакокінетику ензалутаміду.
Показання
Лікарський засіб Кстанді показаний для лікування:
метастатичного кастраційно-резистентного раку передміхурової залози у дорослих чоловіків без симптомів або з помірними симптомами на фоні невдалої андрогендеприваційної терапії при відсутності клінічних показань до проведення хіміотерапії;
метастатичного кастраційно-резистентного раку передміхурової залози у дорослих чоловіків з прогресуванням захворювання під час або після хіміотерапії, що включала доцетаксел.
Протипоказання
Підвищена чутливість до активної речовини чи до будь-якої з допоміжних речовин. Протипоказано вагітним жінкам та жінкам, що можуть завагітніти (див. розділ «Застосування у період вагітності або годування груддю»).
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Лікарські засоби, що можуть впливати на рівень ензалутаміду.
Інгібітори CYP2C8
Фермент CYP2C8 відіграє важливу роль в елімінації ензалутаміду та у формуванні його активного метаболіту. Після перорального прийому гемфіброзилу, потужного інгібітору CYP2C8 (600 мг двічі на день), у здорових добровольців чоловічої статі показник AUC ензалутаміду збільшувався на 326%, а Cmax ензалутаміду зменшувався на 18%. Значення AUC незв'язаного ензалутаміду та незв'язаного активного метаболіту збільшувалось на 77%, а показник Cmax знижувався на 19%. Слід уникати одночасного застосування або застосовувати з обережністю ензалутамід із потужними інгібіторами CYP2C8 (наприклад гемфіброзилом). Якщо пацієнту необхідно одночасно застосовувати потужний інгібітор CYP2C8, слід знизити дозу ензалутаміду до 80 мг один раз на день (див. розділ «Спосіб застосування та дози»).
Інгібітори CYP3A4
Фермент CYP3A4 відіграє незначну роль в метаболізмі ензалутаміду. Після перорального застосування потужного інгібітору CYP3A4 ітраконазолу (200 мг один раз на день) у здорових добровольців чоловічої статі показник AUC ензалутаміду збільшувався на 41%, тоді як значення Cmax не змінювалось. Показник AUC незв'язаного ензалутаміду та незв'язаного активного метаболіту збільшувався на 27%, тоді як Cmax залишався без змін. При одночасному застосуванні лікарського засобу Кстанді з інгібіторами CYP3A4 не потрібно проводити корекцію дози.
CYP2C8 та індуктори CYP3A4
Після перорального застосування помірного індуктора ферменту CYP2C8 та сильного індуктора ферменту CYP3A4 препарату рифампіцин (600 мг один раз на добу щоденно) у здорових чоловіків AUC ензалутаміду та активного метаболіту знизилася на 37%, а Cmax не змінювалася. При одночасному застосуванні лікарського засобу Кстанді з індукторами CYP2C8 або CYP3A4 корекція дози не потрібна.
Вплив ензалутаміду на інші лікарські засоби.
Індуктори ферментів.
Ензалутамід є потужним індуктором ферментів, який підвищує синтез багатьох ферментів і транспортерів, тому очікується взаємодія з численними лікарськими засобами, що є субстратами ферментів чи транспортерів. Зниження концентрації в плазмі крові може бути істотним і призводити до втрати або зменшення клінічного ефекту. Також існує ризик утворення активних метаболітів. До ферментів, утворення яких може бути індуковано, належать CYP3A в печінці та кишечнику, CYP2B6, CYP2C9, CYP2C19 та уридин-5’-дифосфат глюкоронозилтрансфераза. Також можлива індукція транспортного білка Р-глікопротеїну та інших транспортерів, а також, наприклад, білка мультирезистентності лікарських засобів 2 (MRP2), білка резистентності раку молочної залози (BCRP) та органічного аніон-транспортуючого поліпептиду 1В1 (ОАТР1В1).
Дослідження in vivo показали, що ензалутамід є потужним індуктором CYP3A4 і помірним індуктором CYP2C9 та CYP2C19. Одночасне застосування ензалутаміду (160 мг один раз на день) у пацієнтів з раком передміхурової залози призводило до зниження AUC мідазоламу (субстрат CYP3A4) на 86%, до зниження AUC S-варфарину (субстрат CYP2C9) на 56% та до зниження AUC омепразолу (субстрат CYP2C19) на 70%. Також можлива індукція UGT1А1. В клінічному дослідженні у пацієнтів з метастатичним кастраційно-резистентним раком передміхурової залози застосування лікарського засобу Кстанді (160 мг один раз на день) не мало клінічно значимого впливу на фармакокінетику доцетакселу, який вводили внутрішньовенно (75 мг/м2 кожні 3 тижні). AUC доцетакселу знизилася на 12% [середнє геометричне відношення (СГВ) = 0,882 (90% ДІ: 0,767, 1,02)], тоді як Cmax знизилася на 4% [СГВ = 0,963 (90% ДІ: 0,834, 1,11)].
Також очікується взаємодія з нижчезазначеними лікарськими засобами, що елімінуються в процесі метаболізму чи активного транспорту. Слід уникати одночасного застосування цих лікарських засобів або застосовувати з обережністю, якщо терапевтична дія даних лікарських засобів має велике значення для пацієнта і складно провести корекцію дози на підставі моніторингу ефективності чи рівня концентрації в крові. Вважається, що ризик ураження печінки після прийому парацетамолу вищий у пацієнтів, яким одночасно застосовували індуктори ферментів.
До лікарських засобів, що можуть взаємодіяти з препаратом, належать такі групи лікарських засобів:
Аналгетики (наприклад фентаніл, трамадол)
Антибіотики (наприклад кларитроміцин, доксициклін)
Протипухлинні препарати (наприклад кабазитаксел)
Антикоагулянти (наприклад аценокумарол, варфарин)
Протиепілептичні засоби (наприклад карбамазепін, клоназепам, фенітоїн, примідон, вальпроєва кислота)
Нейролептики (наприклад галоперидол)
Бета-блокатори (наприклад бісопролол, пропранолол)
Блокатори кальцієвих каналів (наприклад дилтіазем, фелодипін, нікардипін, ніфедипін, верапаміл)
Серцеві глікозиди (наприклад дигоксин)
Кортикостероїди (наприклад дексаметазон, преднізолон)
Противірусні лікарські засоби для лікування ВІЛ-інфекції (наприклад індинавір, ритонавір)
Снодійні лікарські засоби (наприклад діазепам, мідазолам, золпідем)
Статини, що метаболізуються ферментом CYP3A4 (наприклад аторвастатин, симвастатин)
Тиреоїдні лікарські засоби (наприклад левотироксин)
Індукційні властивості ензалутаміду можуть виникати приблизно через 1 місяць після початку лікування після досягнення стабільної концентрації ензалутаміду в плазмі крові, хоча деякий індукційний вплив може проявлятися і раніше. У пацієнтів, які приймають лікарські засоби, що є субстратами CYP2B6, CYP3A4, CYP2C9, CYP2C19 або UGT1A1, слід оцінити можливе зниження фармакологічного ефекту (чи збільшення дії у разі утворення активних метаболітів) протягом першого місяця лікування ензалутамідом і відповідним чином відкорегувати дози. З огляду на тривалий період напіввиведення ензалутаміду (5,8 дня, див. розділ «Спосіб застосування та дози»), вплив на ферменти може зберігатися протягом місяця і більше після припинення застосування ензалутаміду. При припиненні застосування ензалутаміду може виникнути потреба у зниженні дози лікарських засобів.
Субстрати CYP1A2 та CYP2C8
Ензалутамід (160 мг один раз на добу) не викликає клінічно значимих змін AUC або Cmax кофеїну (субстрат CYP1A2) або піоглітазону (субстрат CYP2C8). AUC піоглітазону збільшується на 20%, тоді як Cmax знижується на 18%. AUC та Cmax кофеїну знижується на 11% та 4% відповідно. Якщо субстрати CYP1A2 або CYP2C8 застосовують з лікарським засобом Кстанді, корекція дози не потрібна.
Субстрати P-глікопротеїну
Дані in vitro показують, що ензалутамід може бути інгібітором ефлюксного транспортера Р-глікопротеїну. Не оцінювався вплив ензалутаміду на субстрати Р-глікопротеїну in vivo, проте при клінічному застосуванні ензалутамід може бути індуктором P-глікопротеїну через активацію ядерного рецептора прегнану (прегнан-Х-рецептор). Слід застосовувати із обережністю лікарські засоби із вузьким терапевтичним діапазоном, які є субстратами для Р-глікопротеїну (наприклад, колхіцин, дабігатрану етексилат, дигоксин), при одночасному застосуванні із лікарським засобом Кстанді, а для підтримання оптимальної концентрації в плазмі може виникати потреба у корекції дози.
Субстрати білків резистентності раку молочної залози (BCRP), білків мульти- резистентності лікарських засобів 2 (MRP2), транспортера органічних аніонів людини 3 типу (OAT3) та транспортера органічних катіонів людини 1 (OCT1)
На підставі даних лабораторних досліджень неможливо виключити інгібування BCRP та MRP2 (в кишечнику), а також транспортерів органічних аніонів людини 3 типу (OAT3) і транспортерів органічних катіонів людини 1 (OCT1) (системного). Теоретично можлива індукція цих транспортерів, сумарний вплив на сьогодні невідомий.
Лікарські засоби, що подовжують інтервали QT
В зв’язку з тим, що андрогендеприваційна терапія може подовжувати інтервал QT, слід ретельно оцінювати ризики одночасного застосування лікарського засобу Кстанді з препаратами, що подовжують інтервал QT, а також лікарськими засобами, при застосуванні яких можливе виникнення аритмії типу torsade de pointes, такими як антиаритмічні препарату класу ІА (наприклад хінідин, дизопірамід) або класу ІІІ (наприклад, аміодарон, соталол, дофетилід, ібутилід), метадон, моксифлоксацин, нейролептики та ін. (див. розділ «Особливості застосування»).
Вплив їжі на експозицію ензалутаміду.
Прийом їжі не має клінічно значимого впливу на ступінь всмоктування ензалутаміду.
Особливості щодо застосування
Ризик розвитку судом.
Лікарський засіб Кстанді слід застосовувати з обережністю пацієнтам з наявністю в анамнезі судом чи інших факторів, що сприяють розвитку судом, включаючи, але не обмежуючись такими факторами: травми головного мозку, інсульт, первинні пухлини головного мозку або метастази в головний мозок, алкоголізм. Крім того, ризик розвитку судом може бути підвищений у пацієнтів, які отримують супутню терапію лікарськими засобами, що знижують судомний поріг. Рішення стосовно продовження терапії при виникненні у пацієнта судом необхідно розглядати в кожному окремому випадку індивідуально.
Синдром задньої оборотної енцефалопатії
В ході застосування пацієнтами лікарського засобу Кстанді рідко повідомлялося про розвиток синдрому задньої оборотної енцефалопатії (див. розділ «Побічні реакції»). Синдром задньої оборотної енцефалопатії – це оборотне неврологічне захворювання, що рідко зустрічається. Воно характеризується такими симптомами, що розвиваються швидко: судоми, головний біль, сплутаність свідомості, сліпота та інші зорові та неврологічні розлади, що супроводжуються або не супроводжуються гіпертензією. Діагноз синдрому задньої оборотної енцефалопатії повинен бути підтверджений результатами томографії головного мозку, краще результатами МРТ. При підтвердженому діагнозі слід припинити прийом лікарського засобу Кстанді.
Одночасне застосування з іншими лікарськими засобами.
Ензалутамід є потужним індуктором ферментів і може призвести до зниження ефективності багатьох лікарських засобів, що часто застосовуються (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Тому перед початком застосування ензалутаміду необхідно провести аналіз лікарських засобів, що одночасно застосовуються з ензалутамідом. Також препарат взаємодіє з лікарськими засобами, які виводяться в процесі метаболізму або активного транспорту (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Якщо їх терапевтичний ефект має велике значення для пацієнта і корекцію дози на основі контролю ефективності або концентрації в плазмі зробити не так просто, прийому цих лікарських засобів слід уникати або застосовувати їх з обережністю.
Необхідно уникати одночасного застосування варфарину та кумариноподібних антикоагулянтів. При одночасному застосуванні лікарського засобу Кстанді з антикоагулянтами, що метаболізуються CYP2C9 (такими як варфарин чи аценокумарол), слід додатково контролювати міжнародне нормалізоване відношення (МНВ) (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Ниркова недостатність
Слід дотримуватися обережності при застосуванні пацієнтам із тяжкою нирковою недостатністю, оскільки застосування ензалутаміду таким пацієнтам не вивчалося.
Тяжка печінкова недостатність
У пацієнтів із тяжкою печінковою недостатністю відмічалося збільшення періоду напіввиведення лікарського засобу, що, можливо, пов’язано із розподілом в тканинах. Клінічне значення цього спостереження невідоме. Може бути потрібно більше часу для досягнення стабільних концентрацій і максимального фармакологічного ефекту, а також часу для початку та зниження індукції ферментів (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Недавно перенесені серцево-судинні захворювання.
В дослідження 3 фази не включали пацієнтів, які недавно перенесли інфаркт міокарда (протягом останніх 6 місяців) чи пацієнтів із нестабільною стенокардією (протягом останніх 3 місяців), пацієнтів із серцевою недостатністю класу ІІІ–IV за шкалою Нью-Йоркської кардіологічної асоціації (NYHA), за винятком пацієнтів із фракцією викиду лівого шлуночка (ФВ ЛВ) ≥ 45%, брадикардією чи неконтрольованою гіпертензією. Ці дані слід брати до уваги у разі призначення лікарського засобу Кстанді таким пацієнтам.
Андрогендеприваційна терапія може подовжувати інтервал QT
У пацієнтів із подовженим інтервалом QT або з факторами, що сприяють розвитку подовженого інтервалу QT (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»), лікар перед призначення лікарського засобу Кстанді повинен оцінити співвідношення користь/ризик, включаючи можливість виникнення шлуночкової тахікардії типу пірует.
Одночасне застосування з хіміотерапією.
Безпека та ефективність одночасного застосування Кстанді з цитотоксичною хіміотерапією не оцінювались. Одночасне застосування ензалутаміду не має клінічно значимого впливу на фармакокінетику доцетакселу, що застосовується внутрішньовенно (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»), проте не можна виключити збільшення частоти розвитку нейтропенії, викликаної застосуванням доцетакселу.
Допоміжні речовини.
Кстанді містить сорбітол (E 420). Пацієнтам з рідкісною вродженою непереносимістю фруктози не слід приймати цей лікарський засіб.
Реакції гіперчутливості.
При застосуванні ензалутаміду спостерігалися алергічні реакції, що проявлялися симптомами, включаючи набряк язика, набряк губ та глотки (див. розділ «Побічні реакції»).
Застосування у період вагітності або годування груддю.
Відсутні дані щодо застосування лікарського засобу Кстанді жінкам під час вагітності, цей лікарський засіб не призначений для жінок репродуктивного віку. Лікарський засіб може спричинити шкоду для ненародженої дитини або призвести до потенційної втрати вагітності при застосуванні вагітною жінкою.
Контрацепція для чоловіків і жінок
Невідомо, чи ензалутамід або його метаболіти присутні в спермі. Якщо пацієнт має сексуальні відносини з вагітною жінкою, слід використовувати презервативи під час лікування ензалутамідом і протягом 3 місяців після закінчення прийому ензалутаміду. Якщо пацієнт має статеві контакти з жінкою репродуктивного віку, у період лікування і протягом 3 місяців після припинення застосування ензалутаміду слід застосовувати презервативи і інші ефективні методи контрацепції. Дослідження на тваринах показують наявність репродуктивної токсичності.
Вагітність та лактація
Ензалутамід не застосовується жінкам. Ензалутамід протипоказаний вагітним жінкам та жінкам репродуктивного віку (див. розділ «Протипоказання»). Невідомо, чи присутній ензалутамід в грудному молоці жінок. Проте ензалутамід та/або його метаболіти присутні в молоці щурів.
Здатність до запліднення
Дослідження на тваринах показали, що ензалутамід впливає на репродуктивну систему у самців щурів та собак.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Так як при застосуванні ензалутаміду спостерігалися психічні і неврологічні порушення, у т.ч. судоми, ензалутамід може мати помірний вплив на здатність керувати автомобілем чи працювати з іншими механізмами (див. розділ «Побічні реакції»). Пацієнтів з наявністю в анамнезі судом або з іншими факторами, що сприяють розвитку судом (див. розділ «Особливості застосування»), слід попереджати про можливий ризик при керуванні автомобілем чи роботі з іншими механізмами. Дослідження впливу ензалутаміду на здатність керувати автотранспортом або іншими механізмами не проводились.
Спосіб застосування та дози
Рекомендована добова доза 160 мг (4 капсули по 40 мг) 1 раз на добу.
Медикаментозна кастрація з використанням аналога ЛГРГ повинна бути продовжена під час лікування пацієнтів, яким не проводили хірургічну кастрацію.
Капсули слід ковтати цілими, запиваючи водою, можна застосовувати незалежно від прийому їжі.
Якщо пацієнт пропустив прийом Кстанді в звичайний час, призначену дозу слід прийняти якомога швидше до звичайного часу. Якщо пацієнт пропустив прийом препарату протягом цілого дня, лікування слід відновити наступного дня зі звичайної добової дози.
Якщо у пацієнта розвивається токсичність ІІІ ступеня і вище або небезпечні побічні реакції, прийом препарату необхідно відмінити на один тиждень або до зниження симптомів до рівня ІІ ступеня токсичності і нижче, а потім, якщо це виправдано, відновити прийом в такій же або в зменшеній дозі (120 або 80 мг).
Одночасний прийом із сильними інгібіторами ферменту CYP2C8.
По можливості слід уникати одночасного застосування сильних інгібіторів ферменту CYP2C8. Якщо пацієнт повинен одночасно приймати сильний інгібітор ферменту CYP2C8, необхідно знизити дозу ензалутаміду до 80 мг один раз на добу. Якщо припинено застосування сильного інгібітору ферменту CYP2C8, дозу ензалутаміду слід підвищити до початкового рівня (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Пацієнти літнього віку.
Немає необхідності корекції дози для пацієнтів літнього віку (див. «Фармакодинаміка», «Фармакокінетика»).
Печінкова недостатність
Немає необхідності корегувати дозу пацієнтам з печінковою недостатністю легкого, середнього та тяжкого ступеня (клас А, В та С відповідно згідно з класифікацією Чайлда – П’ю). Хоча у пацієнтів з тяжкою печінковою недостатністю відмічався подовжений період напіввиведення препарату (див. розділи «Особливості застосування», «Фармакокінетичні властивості»).
Ниркова недостатність.
Відсутня необхідність корекції дози для пацієнтів з нирковою недостатністю легкого або середнього ступеня тяжкості (див. розділ «Фармакокінетика»). Слід дотримуватись обережності щодо пацієнтів з тяжкою нирковою недостатністю чи термінальною стадією ниркової недостатності (див. розділ «Особливості застосування»).
Діти.
Відсутні дані щодо застосування ензалутаміду дітям.
Передозування
Відсутній антидот ензалутаміду. Лікування ензалутамідом слід припинити у разі передозування і вжити відповідних заходів, враховуючи те, що період напіввиведення становить 5,8 дня. У разі передозування у пацієнтів можливий підвищений ризик виникнення судом.
Побічні ефекти
Найчастішими побічними реакціями були астенія/втомлюваність, припливи, головний біль та гіпертонія. Інші побічні реакції включали падіння, непатологічні переломи, когнітивні розлади та нейтропенію.
Судоми виникали в 0,4% пацієнтів, які отримували ензалутамід, у 0,1% пацієнтів групи плацебо та в 0,3% пацієнтів, які отримували бікатуламід. При лікуванні ензалутамідом рідко спостерігались випадки синдрому задньої оборотної енцефалопатії див. розділ «Особливості застосування»).
Нижче наведені побічні реакції, розподілені за частотою: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100), рідко (від ≥1/10 000 до <1/1000), дуже рідко (<1/10 000), невідомо (неможливо оцінити за наявними даними). Побічні реакції в кожній групі надаються в порядку зменшення серйозності.
Побічні реакції, зареєстровані під час клінічних досліджень або в післяреєстраційному нагляді.
Система організму відповідно до класифікації MEDDRA
Частота
Порушення з боку крові та лімфатичної системи
Нечасто: лейкопенія, нейтропенія
Невідомо*: тромбоцитопенія
Розлади з боку імунної системи
Невідомо*: набряк обличчя, набряк язика, набряк губ, набряк глотки
Загальні розлади
Дуже часто: астенія/втомлюваність
Психічні розлади
Часто: тривожність
Нечасто: зорові галюцинації
Зміни з боку нервової системи
Часто: головний біль, порушення пам’яті, амнезія, порушення уваги, синдром неспокійних ніг
Нечасто: когнітивні розлади, судоми1
Невідомо*: синдром задньої оборотної енцефалопатії
З боку серця
Часто: ішемічна хвороба серця2
Невідомо*: подовження інтервалу QT (див. розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій»)
Порушення з боку репродуктивної системи та молочних залоз
Часто: гінекомастія
Судинні розлади
Дуже часто: припливи, гіпертонія
Шлунково-кишкові розлади
Невідомо*: нудота, блювання, діарея
Зміни з боку шкіри та підшкірної клітковини
Часто: сухість шкіри, свербіж
Невідомо*: висипання
Порушення з боку кістково-м’язової та сполучної тканини
Дуже часто: переломи**
Невідомо*: міалгія, спазми м’язів, м’язова слабкість, біль у спині
Травми, отруєння і ускладнення, пов’язані із процедурами
Часто: падіння
* Спонтанні випадки з післяреєстраційного нагляду.
1За оцінкою з використанням вузького терміну SMQ «судоми», включаючи судоми, великі судомні напади, комплексні парціальні судоми, парціальні судоми та епілептичний стан. Включаючи рідкісні випадки судом із ускладненнями, що призводять до смерті.
2За оцінкою з використанням вузьких термінів SMQ «інфаркт міокарда» та «інші види ішемічної хвороби серця», включаючи такі визначені терміни, які використовуються для означення побічних реакцій, що спостерігаються щонайменше у двох пацієнтів у рандомізованих плацебо-контрольованих дослідженнях 3 фази: стенокардія, ішемічна хвороба серця, інфаркт міокарда, гострий інфаркт міокарда, гострий коронарний синдром, нестабільна стенокардія, ішемія міокарда та артеріосклероз коронарних артерій.
**Включає всі переломи, за винятком патологічних.
Опис окремих побічних реакцій
Судоми
В ході контрольованих клінічних досліджень відмічалися судоми у 13 (0,4%) із 3179 пацієнтів, які приймали 160 мг ензалутаміду на добу, тоді як у 1 пацієнта (0,1%), який приймав плацебо, та у одного пацієнта (0,3%), який приймав бікалутамід, відмічалися судоми. Важливим предиктором ризику розвитку судом є доза, про що свідчать дані доклінічних досліджень та дані досліджень зі збільшенням дози. З обох досліджень виключалися пацієнти з наявністю в анамнезі судом або факторів ризику виникнення судом. В клінічному дослідженні оцінювали виникнення судом у пацієнтів з наявністю фактора ризику виникнення судом (1,6% мали судоми в анамнезі). У 8 (2,2%) із 366 пацієнтів, які приймали ензалутамід, відмічалися судоми. Середня тривалість терапії становила 9,3 місяця.
Невідомий механізм, через який ензалутамід може знижувати судомний поріг. Дані дослідження in vitro вказують на те, що ензалутамід та його активні метаболіти зв’язують і можуть пригнічувати активність хлоридних каналів гамма-аміномасляної кислоти (ГАМК).
Ішемічна хвороба серця
У рандомізованих плацебо-контрольованих клінічних дослідженнях ішемічна хвороба серця спостерігалась у 2,5% пацієнтів, які отримували ензалутамід плюс андрогендеприваційну терапію порівняно з 1,3% пацієнтів, які отримували плацебо плюс андрогендеприваційну терапію.
У разі виникнення побічних ефектів просимо направляти інформацію до представництва Астеллас Фарма Юроп Б. В. на адресу: 04050, м. Київ, вул. Пимоненка, 13, корп. 7-В, офіс 41, тел. 044-490-68-25, факс: 044-490-68-26.
Термін придатності
3 роки.
Умови зберігання
Зберігати при температурі не вище 30 °С.
Упаковка
По 28 капсул у блістері; по 1 блістеру в картонному футлярі; по 4 картонних футляри у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Астеллас Фарма Юроп Б.В., Нідерланди / Astellas Pharma Europe B.V., the Netherlands.
Адреса
Сильвіусвег, 62, 2333 ВЕ Лейден, Нідерланди / Sylviusweg, 62, 2333 BE Leiden, the Netherlands.
Представництво в Україні: 04050, м. Київ, вул. Пимоненка, 13, кор. 7-В, оф. 41.
Заявник
Астеллас Фарма Юроп Б.В., Нідерланди /Astellas Pharma Europe B.V., the Netherlands
| Особенности | |
| Страна: | Нідерланди |
| ATC – классификация: | L02BB |
| Рецептурное: | Рецепт |
| Срок годности: | 01.01.2050 0:00:00 |
| Форма выпуска: | капсулы |
| Номер регистрации: | UA/14503/01/01 |
| Штрих код: | 4 607 098 451 460 |
| Свойства: | Антиандрогенні засоби |