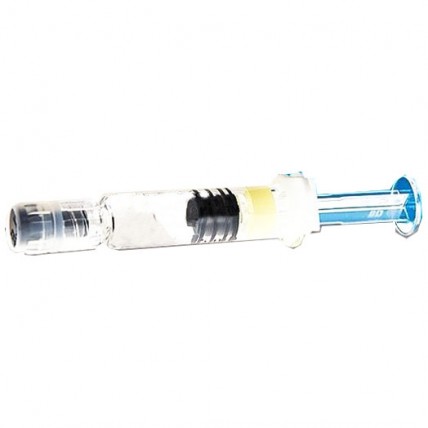
Где купить НИМЕНРИКС порошок с растворителем для инъекций 0,5мл №1
С доставкой
Аптека
Аптека
ФАРМАСФЕРА №2
Посмотреть на карте
ул. Смелянская 55, Черкассы
Пн - Пт с 08.00 до 20.00
Сб-Вс с 08.00 до 18.00
без выходных
В наличии 9 шт.
Аптека №3 ТОВ "7Я+"
Посмотреть на карте
ул. Антоновича 102, г. Львов
Пн - Пт с 08.00 до 19.00
Сб с 08.00 до 16.00
Вс - выходной
Нет в наличии
Аптечный пункт АЛЬТА-С №1
Посмотреть на карте
ул. Верховинная, 69 корпус 2 (КГК Онкологический центр), Киев
Пн - Пт с 8:00 до 18:00 Сб - Вс Выходной
Нет в наличии
Аптечный пункт АЛЬТА-С №2
Посмотреть на карте
ул. Харьковское шоссе, 121 корпус 4 детская поликлиника (Красный хутор КГКБ №1)
Пн - Пт с 8:00 до 18:00 Сб - Вс Выходной
Нет в наличии
Аптека АЛЬТА-С №3
Посмотреть на карте
ул. Шевченка, 5, пгт Кожанка, Фастовский р-н Киевская обл.
Пн - Пт с 8:00 до 17:00 Сб - Вс с 9:00 до 14:00
Нет в наличии
С доставкой
Аптека
Аптека
ФАРМАСФЕРА №3
Нет в наличии
ТОВ "7я+"
Нет в наличии
С доставкой
Аптека
Аптека
ФАРМЦЕНТР №2
Посмотреть на карте
Киев пр. Любомира Гузара,3 корп.11, Киев
Пн - Пт с 8:00 до 19:00, Сб - с 9:00 до 14:00, Вс - выходной
Нет в наличии
С доставкой
Аптека 7Я №1
Нет в наличии
Аптечный пункт ФАРМЦЕНТР №2
Посмотреть на карте
ул. Платона Майбороды 32, корп. 6, Киев
Пн - Пт: с 8-00 до 18:00, Сб: с 9-00 до 15:00, Вс: Выходной
Нет в наличии
С доставкой
Аптека 7Я+ №1
Нет в наличии
Посмотреть на карте
Житомирская обл., Попельнянский район, с. Почуйки, ул. Мира 46 (Амбулатория)
Пн-Пт с 09:00 до 15:30
Сб
Вс – Выходной.
Нет в наличии
НІМЕНРИКС® порошок та розчинник для розчину для ін’єкцій 1 доза
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Німенрикс®/Nimenrix®
Склад:
Після відновлення одна доза (0,5 мл) містить:
діючі речовини:
Полісахарид Neisseria meningitidis серогрупи А1 5 мкг
Полісахарид Neisseria meningitidis серогрупи С1 5 мкг
Полісахарид Neisseria meningitidis серогрупи W-1351 5 мкг
Полісахарид Neisseria meningitidis серогрупи Y1 5 мкг
1 кон’югований з білком-носієм правцевого анатоксину — 44 мкг.
Допоміжні речовини: сахароза, трометамол.
Розчинник: натрію хлорид, вода для ін’єкцій.
Лікарська форма.
Порошок та розчинник для розчину для ін’єкцій.
Основні фізико-хімічні властивості: біла маса або порошок; після відновлення розчинником: прозора та безбарвна рідина.
Фармакотераневтична група. Антибактеріальні вакцини. Вакцина для профілактики менінгококової інфекції. Код ATX: J07AH08.
Імунологічні і біологічні властивості.
Фармакодинаміка.
Механізм дії
Антикапсульні менінгококові антитіла захищають від менінгококових захворювань за рахунок комплемент-опосередкованої бактерицидної активності. За результатами кількісного визначення з використанням кролячого комплементу (rSBA) або комплементу людини (hSBA) доведено, що препарат викликає вироблення бактерицидних антитіл проти капсульних полісахаридів Neisseria meningitidis груп А, С, W-135 та Y.
Імуногенність у немовлят
Було проведено два клінічні дослідження за участі немовлят: MenACWY-TT-083 та MenACWY-TT-087.
У клінічному дослідженні MenACWY-TT-083 першу дозу вводили у віці від 6 до 12 тижнів, другу дозу — через 2 місяці, а третю (бустерну) дозу — у віці приблизно 12 місяців. Вакцину DTaP-HBV-IPV/Hib та 10-валентну пневмококову вакцину вводили одночасно. Препарат Німенрикс® викликав продукування бактерицидних антитіл проти чотирьох менінгококових груп. Відповідь проти групи С була не слабшою за відповідь, яку викликають ліцензовані вакцини MenC-CRM та MenC-ТТ, враховуючи відсоток з титрами rSBA ≥ 8 через місяць після другої дози. Див. таблицю 1.
Таблиця 1. Імунна відповідь (продукування бактерицидних антитіл) (rSBA*) та (hSBA**) у немовлят після введення двох доз з інтервалом 2 місяці і після введення бустерної дози у віці 12 місяців (дослідження MenACWY-TT-083)
Менінгококова
група
Група
вакцини
rSBA* hSBA**
N ≥8
(95% ДІ)
GMT
(95% ДІ)
N ≥8
(95 % ДІ)
GMT
(95 % ДІ)
А Німенрикс® Після дози 2(1) 456 97,4% 203 202 96,5% 157
(95,4; 98,6) (182; 227) (93,0; 98,6) (131; 188)
Після бустерної
дози(1)
462
99,6%
(98,4; 99,9)
1561
(1412; 1725)
214
99,5%
(97,4; 100)
1007
(836; 1214)
С Німенрикс® Після дози 2(1) 456
98,7%
(97,2; 99,5)
612
(540; 693)
218
98,6%
(96,0; 99,7)
1308
(1052;1627)
Після бустерної
дози(1) 463 99,8% 1177 221 99,5% 4992
(98,8; 100) (1059; 1308) (97,5; 100) (4086; 6100)
Вакцина MenC-CRM Після дози 2(1) 455 99,6% 958 202 100% 3188
(98,4; 99,9) (850; 1079) (98,2; 100) (2646; 3841)
Після бустерної
дози(1) 446 98,4% 1051 216 100% 5438
(96,8; 99,4) (920; 1202) (98,3; 100) (4412; 6702)
Вакцина
МеnС-ТТ Після дози 2(1)
457
459
100%
(99,2; 100)
1188
(1080; 1307)
226
219
100%
(98,4; 100)
2626
(2219;3109)
Після бустерної
дози(1) 100% 1960 100% 5542
(99,2; 100) (1776; 2163) (98,3; 100) (4765; 6446)
W Німенрикс® Після дози 2(1) 455
99,1%
(97,8; 99,8)
1605
(1383; 1862)
217
100%
(98,3; 100)
753
(644; 882)
Після бустерної
дози(1) 462 99,8% 2777 218 100% 123
(98,8; 100) (2485; 3104) (98,3; 100) (4504; 5826)
Y Німенрикс® Після дози 2(1) 456 98,2% 483 214 97,7% 328
(96,6; 99,2) (419; 558) (94,6; 99.2) (276; 390)
Після бустерної
дози(1) 462 99,4% 881 217 100% 2954
(99,1; 99,9) (787; 986) (98,3; 100) (2498; 3493)
Аналіз імуногенності проводили на первинній когорті «відповідно до протоколу» (АТР) для аналізу імуногенності.
* Аналіз із rSBA проводили в лабораторіях Служби громадського здоров’я Англії (РНЕ) у Великобританії.
** Аналіз із hSBA проводили в лабораторіях компанії GSK.
(1) Зразки крові брали через 21–48 днів після вакцинації.
Дані, отримані у дослідженні MenACWY-TT-083 підтримують екстраполяцію даних з імуногенності та режиму дозування для немовлят віком від 12 тижнів до 6 місяців.
У дослідженні MenACWY-TT-087 немовлятам застосовували або одну первинну дозу у віці 6 місяців з подальшою бустерною дозою у віці 15–18 місяців (DTPa-IPV/Hib та 10-валентну пневмококову кон’юговану вакцину застосовували одночасно під час обох вакцинацій), або три первинні дози у віці 2, 4 та 6 місяців з бустерною дозою у віці 15–18 місяців. Одна доза, введена у віці 6 місяців, викликала стійкі rSBA відповіді до серогруп А, С, W-135 та Y, оцінені за відсотком суб’єктів з титрами rSBA ≥ 8 через місяць, які були співставними з відповідями після введення останньої дози із серії трьох первинних доз. Бустерна доза викликала стійкі відповіді до всіх чотирьох менінгококових серогруп, співставні в обох групах по дозуванню.
Відповіді (утворення) бактерицидних антитіл у немовлят віком 6 місяців визначені через місяць після введення однієї первинної дози перед введенням бустерної дози, та через місяць після бустерної дози, наведені у таблиці 2
Таблиця 2. Відповіді (утворення) бактерицидних антитіл (rSBA* та hSBA**)) у немовлят після введення однієї дози у віці 6 місяців та після введення бустерної дози у віці 15-18 місяців (дослідження MenACWY-TT-083)
Менінгококова група
rSBA* hSBA**
N
≥8
(95 % ДІ)
GMT
(95 % ДІ)
N
≥8
(95 % ДІ)
GMT
(95 % ДІ)
A
Після дози 1 (1)
163
131
98,80%
(95,6; 99,9)
1332,9
(1035,2; 1716,2)
59
71
98,30%
(90,9; 100)
271
(206; 355)
Перед бустерною дозою
81,70%
(74; 87,9)
125,3
(84,4; 186,1)
66,20%
(54; 77)
21
(14; 32)
Після бустерної дози
139
99,30%
96,1; 100)
2762,3
(2310,3; 3302,8)
83
100%
(95,7; 100)
1416
(1140; 1758)
С
Після дози 1 (1)
163
99,40%
(96,6; 100)
591,6
(482,3; 725,8)
66
100%
(94,6; 100)
523
(382; 717)
Перед бустерною дозою
131
139
65,60%
(56,9; 73,7)
27,4
(20,6; 36,6)
78
92
96,20%
(89,2; 99,2)
151
(109; 210)
Після бустерної дози
99,30%
(96,1; 100)
2525,2
(2102,1; 3033,3)
100%
(96,1; 100)
13360
(10953; 16296)
W
Після дози 1 (1)
163
131
93,90%
(89,97)
1255,9
(917; 1720)
47
53
87,20%
(74,3; 95,2)
137
(78; 238)
Перед бустерною дозою
77,90%
(69,8; 84,6)
63,3
(45,6; 87,9)
100%
(93,3; 100)
429
(328; 559)
Після бустерної дози
139
100%
(97,4; 100)
3144,7
(2636,9; 3750,4)
59
100%
(93,9; 100)
9016
(7045; 11537)
Y
Після дози 1 (1) 163
98,80%
(95,6; 99,9)
1469,9
(1186,5; 1821)
52
92,30%
(81,5; 97,9)
195
(118; 323)
Перед бустерною дозою
131
139
88,50%
(81,8; 93,4)
106,4
(76,4; 148,1)
61
69
98,40%
(91,2; 100)
389
(292; 518)
Після бустерної дози (1)
100%
(97,4; 100)
2748,6
(2301,4; 3282,6)
100%
(94,8; 100)
5978
(4747; 7528)
Після відновлення вакцину слід відразу використати. Хоча і не рекомендується затримуватися з введенням вакцини, стабільність вакцини зберігається протягом 8 годин при температурі ЗО °С після розведення. Якщо вакцина не була використана протягом 8 годин, вакцину вводити не можна.
Умови зберігання
Зберігати при температурі від 2 до 8 °С. Захищати від світла. Зберігати в недоступному для дітей місці. Не заморожувати.
Після відновлення вакцину слід відразу використати. Якщо вакцина не була використана відразу, умови зберігання відновленої вакцини див. в розділі «Термін придатності». Розчинник можна зберігати при кімнатній температурі (25 °С).
Якщо вакцина або розчинник були заморожені, їх слід утилізувати.
Упаковка
По 1 флакону з порошком (1 доза) в комплекті з розчинником (0,5 мл) у попередньо наповненому шприці та двома голками запаковують у блістер та вкладають у картонну коробку разом з інструкцією для медичного застосування.
По 1 флакону з порошком (1 доза) в комплекті з розчинником (0,5 мл) у попередньо наповненому шприці без голки запаковують у блістер; 10 блістерів вкладають у картонну коробку разом з інструкцією для медичного застосування.
Категорія відпуску.
За рецептом.
Виробник
Пфайзер Менюфекчуринг Бельгія НВ / Pfizer Manufacturing Belgium NV.
.Місцезнаходження виробника га адреса місця провадження його діяльності
Рейксвег 12, Пуурс, 2870, Бельгія / Rijksweg 12, Puurs, 2870, Belgium.
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Німенрикс®/Nimenrix®
Склад:
Після відновлення одна доза (0,5 мл) містить:
діючі речовини:
Полісахарид Neisseria meningitidis серогрупи А1 5 мкг
Полісахарид Neisseria meningitidis серогрупи С1 5 мкг
Полісахарид Neisseria meningitidis серогрупи W-1351 5 мкг
Полісахарид Neisseria meningitidis серогрупи Y1 5 мкг
1 кон’югований з білком-носієм правцевого анатоксину — 44 мкг.
Допоміжні речовини: сахароза, трометамол.
Розчинник: натрію хлорид, вода для ін’єкцій.
Лікарська форма.
Порошок та розчинник для розчину для ін’єкцій.
Основні фізико-хімічні властивості: біла маса або порошок; після відновлення розчинником: прозора та безбарвна рідина.
Фармакотераневтична група. Антибактеріальні вакцини. Вакцина для профілактики менінгококової інфекції. Код ATX: J07AH08.
Імунологічні і біологічні властивості.
Фармакодинаміка.
Механізм дії
Антикапсульні менінгококові антитіла захищають від менінгококових захворювань за рахунок комплемент-опосередкованої бактерицидної активності. За результатами кількісного визначення з використанням кролячого комплементу (rSBA) або комплементу людини (hSBA) доведено, що препарат викликає вироблення бактерицидних антитіл проти капсульних полісахаридів Neisseria meningitidis груп А, С, W-135 та Y.
Імуногенність у немовлят
Було проведено два клінічні дослідження за участі немовлят: MenACWY-TT-083 та MenACWY-TT-087.
У клінічному дослідженні MenACWY-TT-083 першу дозу вводили у віці від 6 до 12 тижнів, другу дозу — через 2 місяці, а третю (бустерну) дозу — у віці приблизно 12 місяців. Вакцину DTaP-HBV-IPV/Hib та 10-валентну пневмококову вакцину вводили одночасно. Препарат Німенрикс® викликав продукування бактерицидних антитіл проти чотирьох менінгококових груп. Відповідь проти групи С була не слабшою за відповідь, яку викликають ліцензовані вакцини MenC-CRM та MenC-ТТ, враховуючи відсоток з титрами rSBA ≥ 8 через місяць після другої дози. Див. таблицю 1.
Таблиця 1. Імунна відповідь (продукування бактерицидних антитіл) (rSBA*) та (hSBA**) у немовлят після введення двох доз з інтервалом 2 місяці і після введення бустерної дози у віці 12 місяців (дослідження MenACWY-TT-083)
Менінгококова
група
Група
вакцини
rSBA* hSBA**
N ≥8
(95% ДІ)
GMT
(95% ДІ)
N ≥8
(95 % ДІ)
GMT
(95 % ДІ)
А Німенрикс® Після дози 2(1) 456 97,4% 203 202 96,5% 157
(95,4; 98,6) (182; 227) (93,0; 98,6) (131; 188)
Після бустерної
дози(1)
462
99,6%
(98,4; 99,9)
1561
(1412; 1725)
214
99,5%
(97,4; 100)
1007
(836; 1214)
С Німенрикс® Після дози 2(1) 456
98,7%
(97,2; 99,5)
612
(540; 693)
218
98,6%
(96,0; 99,7)
1308
(1052;1627)
Після бустерної
дози(1) 463 99,8% 1177 221 99,5% 4992
(98,8; 100) (1059; 1308) (97,5; 100) (4086; 6100)
Вакцина MenC-CRM Після дози 2(1) 455 99,6% 958 202 100% 3188
(98,4; 99,9) (850; 1079) (98,2; 100) (2646; 3841)
Після бустерної
дози(1) 446 98,4% 1051 216 100% 5438
(96,8; 99,4) (920; 1202) (98,3; 100) (4412; 6702)
Вакцина
МеnС-ТТ Після дози 2(1)
457
459
100%
(99,2; 100)
1188
(1080; 1307)
226
219
100%
(98,4; 100)
2626
(2219;3109)
Після бустерної
дози(1) 100% 1960 100% 5542
(99,2; 100) (1776; 2163) (98,3; 100) (4765; 6446)
W Німенрикс® Після дози 2(1) 455
99,1%
(97,8; 99,8)
1605
(1383; 1862)
217
100%
(98,3; 100)
753
(644; 882)
Після бустерної
дози(1) 462 99,8% 2777 218 100% 123
(98,8; 100) (2485; 3104) (98,3; 100) (4504; 5826)
Y Німенрикс® Після дози 2(1) 456 98,2% 483 214 97,7% 328
(96,6; 99,2) (419; 558) (94,6; 99.2) (276; 390)
Після бустерної
дози(1) 462 99,4% 881 217 100% 2954
(99,1; 99,9) (787; 986) (98,3; 100) (2498; 3493)
Аналіз імуногенності проводили на первинній когорті «відповідно до протоколу» (АТР) для аналізу імуногенності.
* Аналіз із rSBA проводили в лабораторіях Служби громадського здоров’я Англії (РНЕ) у Великобританії.
** Аналіз із hSBA проводили в лабораторіях компанії GSK.
(1) Зразки крові брали через 21–48 днів після вакцинації.
Дані, отримані у дослідженні MenACWY-TT-083 підтримують екстраполяцію даних з імуногенності та режиму дозування для немовлят віком від 12 тижнів до 6 місяців.
У дослідженні MenACWY-TT-087 немовлятам застосовували або одну первинну дозу у віці 6 місяців з подальшою бустерною дозою у віці 15–18 місяців (DTPa-IPV/Hib та 10-валентну пневмококову кон’юговану вакцину застосовували одночасно під час обох вакцинацій), або три первинні дози у віці 2, 4 та 6 місяців з бустерною дозою у віці 15–18 місяців. Одна доза, введена у віці 6 місяців, викликала стійкі rSBA відповіді до серогруп А, С, W-135 та Y, оцінені за відсотком суб’єктів з титрами rSBA ≥ 8 через місяць, які були співставними з відповідями після введення останньої дози із серії трьох первинних доз. Бустерна доза викликала стійкі відповіді до всіх чотирьох менінгококових серогруп, співставні в обох групах по дозуванню.
Відповіді (утворення) бактерицидних антитіл у немовлят віком 6 місяців визначені через місяць після введення однієї первинної дози перед введенням бустерної дози, та через місяць після бустерної дози, наведені у таблиці 2
Таблиця 2. Відповіді (утворення) бактерицидних антитіл (rSBA* та hSBA**)) у немовлят після введення однієї дози у віці 6 місяців та після введення бустерної дози у віці 15-18 місяців (дослідження MenACWY-TT-083)
Менінгококова група
rSBA* hSBA**
N
≥8
(95 % ДІ)
GMT
(95 % ДІ)
N
≥8
(95 % ДІ)
GMT
(95 % ДІ)
A
Після дози 1 (1)
163
131
98,80%
(95,6; 99,9)
1332,9
(1035,2; 1716,2)
59
71
98,30%
(90,9; 100)
271
(206; 355)
Перед бустерною дозою
81,70%
(74; 87,9)
125,3
(84,4; 186,1)
66,20%
(54; 77)
21
(14; 32)
Після бустерної дози
139
99,30%
96,1; 100)
2762,3
(2310,3; 3302,8)
83
100%
(95,7; 100)
1416
(1140; 1758)
С
Після дози 1 (1)
163
99,40%
(96,6; 100)
591,6
(482,3; 725,8)
66
100%
(94,6; 100)
523
(382; 717)
Перед бустерною дозою
131
139
65,60%
(56,9; 73,7)
27,4
(20,6; 36,6)
78
92
96,20%
(89,2; 99,2)
151
(109; 210)
Після бустерної дози
99,30%
(96,1; 100)
2525,2
(2102,1; 3033,3)
100%
(96,1; 100)
13360
(10953; 16296)
W
Після дози 1 (1)
163
131
93,90%
(89,97)
1255,9
(917; 1720)
47
53
87,20%
(74,3; 95,2)
137
(78; 238)
Перед бустерною дозою
77,90%
(69,8; 84,6)
63,3
(45,6; 87,9)
100%
(93,3; 100)
429
(328; 559)
Після бустерної дози
139
100%
(97,4; 100)
3144,7
(2636,9; 3750,4)
59
100%
(93,9; 100)
9016
(7045; 11537)
Y
Після дози 1 (1) 163
98,80%
(95,6; 99,9)
1469,9
(1186,5; 1821)
52
92,30%
(81,5; 97,9)
195
(118; 323)
Перед бустерною дозою
131
139
88,50%
(81,8; 93,4)
106,4
(76,4; 148,1)
61
69
98,40%
(91,2; 100)
389
(292; 518)
Після бустерної дози (1)
100%
(97,4; 100)
2748,6
(2301,4; 3282,6)
100%
(94,8; 100)
5978
(4747; 7528)
Після відновлення вакцину слід відразу використати. Хоча і не рекомендується затримуватися з введенням вакцини, стабільність вакцини зберігається протягом 8 годин при температурі ЗО °С після розведення. Якщо вакцина не була використана протягом 8 годин, вакцину вводити не можна.
Умови зберігання
Зберігати при температурі від 2 до 8 °С. Захищати від світла. Зберігати в недоступному для дітей місці. Не заморожувати.
Після відновлення вакцину слід відразу використати. Якщо вакцина не була використана відразу, умови зберігання відновленої вакцини див. в розділі «Термін придатності». Розчинник можна зберігати при кімнатній температурі (25 °С).
Якщо вакцина або розчинник були заморожені, їх слід утилізувати.
Упаковка
По 1 флакону з порошком (1 доза) в комплекті з розчинником (0,5 мл) у попередньо наповненому шприці та двома голками запаковують у блістер та вкладають у картонну коробку разом з інструкцією для медичного застосування.
По 1 флакону з порошком (1 доза) в комплекті з розчинником (0,5 мл) у попередньо наповненому шприці без голки запаковують у блістер; 10 блістерів вкладають у картонну коробку разом з інструкцією для медичного застосування.
Категорія відпуску.
За рецептом.
Виробник
Пфайзер Менюфекчуринг Бельгія НВ / Pfizer Manufacturing Belgium NV.
.Місцезнаходження виробника га адреса місця провадження його діяльності
Рейксвег 12, Пуурс, 2870, Бельгія / Rijksweg 12, Puurs, 2870, Belgium.
| Особенности | |
| Страна: | США |
| ATC – классификация: | J07AH |
| Рецептурное: | Рецепт |
| Срок годности: | 01.01.2050 0:00:00 |
| Форма выпуска: | порошок |
| Номер регистрации: | UA/16901/01/01 |
| Штрих код: | 5 415 062 334 478 |
| Свойства: | Вакцини протименінгококові |
Отзывы
Нет отзывов
Написать отзыв