Де купити КАЛКВЕНС капсули тв. по 100 мг №60 (6х10)
Аптека
ФАРМАСФЕРА №3
Склад
діюча речовина: acalabrutinib;
1 тверда капсула містить акалабрутинібу 100 мг;
допоміжні
речовини: силіконізована мікрокристалічна целюлоза; частково
прежелатинізований крохмаль; натрію крохмальгліколят, тип A; магнію
стеарат;
склад твердої желатинової оболонки капсули: оболонка
(желатин, заліза оксид жовтий (E 172), індиготин – FD&C Blue 2 (E
132), титану діоксид (E 171); чорнила (поливальний сироп з шелаком – 45 %
(20 % етерифікований) в етанолі, заліза оксид чорний (Е 172),
пропіленгліколь, амонію гідроксид 28 %)).
Лікарська форма
Капсули тверді.
Основні
фізико-хімічні властивості: тверда капсула № 1 із синьою непрозорою
кришкою та жовтим непрозорим корпусом, з чорним написом “ACA100mg”.
Фармакотерапевтична група
Антинеопластичні засоби, інгібітори протеїнкінази. Акалабрутиніб. Код ATX L01E L02.
Фармакологічні властивості
Механізм дії.
Акалабрутиніб
— це селективний інгібітор тирозинкінази Брутона (ТКБ). ТКБ є
сигнальною молекулою антигенних рецепторів В-клітин (ВКР) та рецептора
цитокінів. У B-клітинах передача сигналів за допомогою ТКБ сприяє
виживанню та проліферації B-клітин та необхідна для клітинної адгезії,
міграції та хемотаксису.
Акалабрутиніб та його активний метаболіт
АСР-5862 формують ковалентний зв’язок із цистеїновим залишком в
активному центрі ТКБ, що призводить до необоротної інактивації ТКБ з
мінімальними нецільовими взаємодіями.
Фармакодинаміка.
У
пацієнтів із В-клітинними лімфопроліферативними захворюваннями при
отриманні акалабрутинібу у дозі 100 мг двічі на добу медіана зв’язування
ТКБ у рівноважному стані в периферичній крові більше 95 % зберігалася
понад 12 годин, що призводило до інактивації ТКБ протягом
рекомендованого інтервалу між прийомом доз лікарського засобу.
Кардіоелектрофізіологія
Вплив
акалабрутинібу на інтервал QTc був оцінений у 46 здорових чоловіків та
жінок в рандомізованому подвійно сліпому ретельному дослідженні QT із
застосуванням плацебо і позитивного контролю. У надтерапевтичній дозі,
яка в 4 рази перевищувала максимальну рекомендовану дозу, Калквенс не
призводив до клінічно значущого збільшення інтервалу QT/QTc (наприклад,
не перевищував або дорівнював 10 мс) (див. розділи «Особливості
застосування» і «Побічні реакції»).
Клінічна ефективність і безпека
Пацієнти з раніше не лікованим хронічним лімфоцитарним лейкозом (ХЛЛ)
Безпека
та ефективність застосування лікарського засобу Калквенс для лікування
раніше не лікованого ХЛЛ були оцінені в рандомізованому мультицентровому
відкритому дослідженні фази 3 (ELEVATE-TN) за участю 535 пацієнтів.
Пацієнти отримували лікарські засоби за такими схемами лікування:
Калквенс + обінутузумаб, Калквенс як монотерапія або обінутузумаб +
хлорамбуцил. У дослідження ELEVATE-TN були включені пацієнти віком від
65 років або пацієнти віком від 18 до 65 років із супутніми
захворюваннями, при цьому 27,9 % пацієнтів мали КК < 60 мл/хв. У 16,1
% пацієнтів віком до 65 років середній бал за шкалою CIRS-G становив 8.
Учасникам дослідження дозволялося приймати антитромботичні лікарські
засоби. З дослідження були виключені пацієнти, які потребували отримання
антикоагулянтної терапії варфарином або аналогічними антагоністами
вітаміну К.
Пацієнти були рандомізовані у співвідношенні 1:1:1 на 3 групи і отримували:
Калквенс + обінутузумаб (Калквенс + О): Калквенс приймали у дозі 100 мг
двічі на добу, починаючи з дня 1 циклу 1, до прогресування захворювання
або виникнення неприйнятного токсичного ефекту. Обінутузумаб
застосовували з дня 1 циклу 2 протягом максимум 6 циклів терапії: у
загальній дозі 1000 мг – в дні 1 і 2 (100 мг у день 1 та 900 мг у день
2), 8 та 15 циклу 2, а потім 1000 мг у день 1 циклів 3–7. Кожний цикл
тривав 28 днів.
Калквенс як монотерапія: Калквенс приймали у дозі
100 мг двічі на добу до прогресування захворювання або виникнення
неприйнятного токсичного ефекту.
Обінутузумаб + хлорамбуцил (О +
ХЛ): обінутузумаб і хлорамбуцил застосовували протягом максимум 6 циклів
терапії: обінутузумаб у загальній дозі 1000 мг – в дні 1 і 2 (100 мг у
день 2 і 900 мг у день 2), 8 та 15 циклу 1, а потім 1000 мг у день 1
циклів 2–6; хлорамбуцил у дозі 0,5 мг/кг – в дні 1 та 15 циклів 1–6.
Кожний цикл тривав 28 днів.
Пацієнти були стратифіковані за
мутаційним статусом делеції ділянки 17p хромосоми (за наявністю або
відсутністю), функціональним статусом за шкалою ECOG (0 або 1 проти 2)
та географічним регіоном (Північна Америка та Західна Європа проти інших
регіонів). Після підтвердження прогресування захворювання 45 пацієнтів,
які були рандомізовані для отримання комбінації О + ХЛ, перейшли на
Калквенс як монотерапію. У таблиці 1 наведено основні демографічні дані
та характеристики захворювання досліджуваної популяції.
Таблиця 1
Характеристики пацієнтів із раніше не лікованим ХЛЛ (у дослідженні ELEVATE-TN)
Характеристика | Калквенс + обінутузумаб N = 179 | Калквенс як монотерапія N = 179 | Обінутузумаб + хлорамбуцил N = 177 | |
| Медіана віку в роках (діапазон) | 70 (41–88) | 70 (44–87) | 71 (46–91) | |
| Чоловіки, % | 62 | 62 | 59,9 | |
| Представники європеоїдної раси, % | 91,6 | 95 | 93,2 | |
| Функціональний статус за шкалою ECOG 0-1, % | 94,4 | 92,2 | 94,4 | |
| Медіана часу з моменту діагнозу (місяців) | 30,5 | 24,4 | 30,7 | |
| Генералізована лімфаденопатія з вузлами ≥ 5 см, % | 25,7 | 38 | 31,1 | |
| Цитогенетичний профіль/ хромосомна аномалія, досліджена методом флуоресцентної гібридизації in situ, % |
|
|
| |
| Делеція ділянки 17p хромосоми | 9,5 | 8,9 | 9 | |
| Делеція ділянки 11q хромосоми | 17,3 | 17,3 | 18,6 | |
| Мутація гена TP53 | 11,7 | 10,6 | 11,9 | |
| Немутований ген варіабельних важких ланцюгів імуноглобуліну | 57,5 | 66,5 | 65,5 | |
| Складний каріотип (≥ 3 аномалій) | 16,2 | 17,3 | 18,1 | |
| Стадія ХЛЛ за Rai, % |
|
|
| |
| 0 | 1,7 | 0 | 0,6 | |
| I | 30,2 | 26,8 | 28,2 | |
| II | 20,1 | 24,6 | 27,1 | |
| III | 26,8 | 27,9 | 22,6 | |
| IV | 21,2 | 20,7 | 21,5 | |
Первинною
кінцевою точкою була виживаність без прогресування (ВБП) групи
пацієнтів, які отримували Калквенс + О, у порівнянні з групою пацієнтів,
які отримували О+ХЛ, за оцінкою незалежної експертної комісії (НЕК)
відповідно до критеріїв Міжнародного семінару з хронічного
лімфоцитарного лейкозу (IWCLL), проведеного у 2008 році, із включенням
роз’яснення щодо лімфоцитозу, пов’язаного з лікуванням (Cheson 2012).
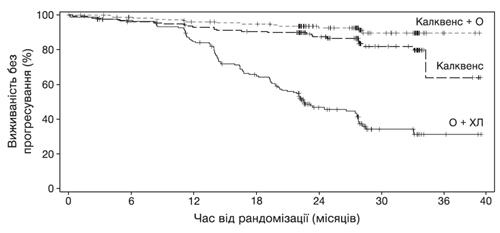
При медіані подальшого спостереження 28,3 місяця ВБП пацієнтів із раніше
не лікованим ХЛЛ за оцінкою НЕК у групі застосування Калквенс + О
показала статистично значуще зниження ризику прогресування захворювання
або смерті на 90 % порівняно з групою застосування О + ХЛ. Результати
оцінки ефективності наведено в таблиці 2. Криві Каплана – Мейєра для ВБП
наведено на рисунку 1.
Таблиця 2
Ефективність застосування для лікування пацієнтів із ХЛЛ за оцінкою НЕК (у дослідженні ELEVATE-TN)
Показник | Калквенс + обінутузумаб N = 179 | Калквенс монотерапія N = 179 | Обінутузумаб + хлорамбуцил N = 177 |
| Виживаність без прогресування* | |||
| Кількість подій (%) | 14 (7,8) | 26 (14,5) | 93 (52,5) |
| ПЗ, n (%) | 9 (5) | 20 (11,2) | 82 (46,3) |
| Летальні наслідки (%) | 5 (2,8) | 6 (3,4) | 11 (6,2) |
| Медіана (95 % ДІ), місяці | н. д. | н. д. (34,2, н. д.) | 22,6 (20,2, 27,6) |
| ВР† (95 % ДІ) | 0,10 (0,06, 0,17) | 0,20 (0,13, 0,30) | - |
| P-значення | < 0,0001 | < 0,0001 | - |
| Розрахунок за 24 місяці, % (95 % ДІ) | 92,7 (87,4, 95,8) | 87,3 (80,9, 91,7) | 46,7 (38,5, 54,6) |
| Загальна виживаністьa | |||
| Летальні наслідки (%) | 9 (5) | 11 (6,1) | 17 (9,6) |
| Відношення ризиків (95 % ДІ)† | 0,47 (0,21, 1,06) | 0,60 (0,28, 1,27) | - |
| Найкраща загальна частота відповіді* (ПВ + ПВн + ЧВм + ЧВ) | |||
| ЗЧВ, n (%) | 168 (93,9) | 153 (85,5) | 139 (78,5) |
| (95 % ДІ) | (89,3, 96,5) | (79,6, 89,9) | (71,9, 83,9) |
| P-значення | < 0,0001 | 0,0763 | - |
| ПВ, n (%) | 23 (12,8) | 1 (0,6) | 8 (4,5) |
| ПВн, n (%) | 1 (0,6) | 0 | 0 |
| ЧВn, n (%) | 1 (0,6) | 2 (1,1) | 3 (1,7) |
| ЧВ, n (%) | 143 (79,9) | 150 (83,8) | 128 (72,3) |
ПЗ
– прогресування захворювання; ДІ – довірчий інтервал; ВР – відношення
ризиків; ЗЧВ – загальна частота відповіді; н. д. – не досягнуто; ПВ –
повна відповідь; ПВн – повна відповідь із неповним відновленням
параметрів крові; ЧВn – часткова нодулярна відповідь; ЧВ – часткова
відповідь.
* За оцінкою НЕК.
† На основі стратифікованої моделі пропорційних ризиків Кокса.
a Медіана ЗВ не була досягнута в обох групах.
Кількість пацієнтів у групі ризику | ||||||||||||||
| Місяць | 0 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 27 | 30 | 33 | 36 | 39 |
| Калквенс | 179 | 166 | 161 | 157 | 153 | 150 | 148 | 147 | 103 | 94 | 43 | 40 | 4 | 3 |
| Калквенс + О | 179 | 176 | 170 | 168 | 163 | 160 | 159 | 155 | 109 | 104 | 46 | 41 | 4 | 2 |
| О + ХЛ | 177 | 162 | 157 | 151 | 136 | 113 | 102 | 86 | 46 | 41 | 13 | 13 | 3 | 2 |
Рис. 1. Крива Каплана – Мейєра для ВБП у пацієнтів із ХЛЛ (ITT-популяція) за оцінкою НЕК (у дослідженні ELEVATE-TN).
Результати
ВБП для схем лікування, що включають Калквенс з обінутузумабом або без
нього, були аналогічними у всіх підгрупах, включно з підгрупами з
ознаками високого ризику. У популяції ХЛЛ із високим ризиком (з делецією
17p, делецією 11q, мутацією гена TP53 та немутованим геном варіабельних
важких ланцюгів імуноглобуліну) ВР для ВБП для схем лікування, що
включали Калквенс з обінутузумабом або без нього, становило 0,08 [95 %
ДІ (0,04, 0,15)] порівняно з 0,13 [95 % ДІ (0,08, 0,21)] для схеми
обінутузумаб + хлорамбуцил.
Таблиця 3
Аналіз ВБП у підгрупах (у дослідженні ELEVATE-TN)
Показник | Калквенс, монотерапія | Калквенс + О | ||||
| N | Відношення ризиків | 95 % ДІ | N | Відношення ризиків | 95 % ДІ | |
| Усі пацієнти | 179 | 0,20 | (0,13, 0,30) | 179 | 0,10 | (0,06, 0,17) |
| Делеція 17p |
|
|
|
|
|
|
| Так | 19 | 0,20 | (0,06, 0,64) | 21 | 0,13 | (0,04, 0,46) |
| Ні | 160 | 0,20 | (0,12, 0,31) | 158 | 0,09 | (0,05, 0,17) |
| Мутація гена TP53 |
|
|
|
|
|
|
| Так | 19 | 0,15 | (0,05, 0,46) | 21 | 0,04 | (0,01, 0,22) |
| Ні | 160 | 0,20 | (0,12, 0,32) | 158 | 0,11 | (0,06, 0,20) |
| Делеція 17p та/або мутація TP53 |
|
|
|
|
|
|
| Так | 23 | 0,23 | (0,09, 0,61) | 25 | 0,10, | (0,03, 0,34) |
| Ні | 156 | 0,19 | (0,11, 0,31) | 154 | 0,10 | (0,05, 0,18) |
| Мутація гена варіабельних важких ланцюгів імуноглобуліну |
|
|
|
|
|
|
| З мутацією | 58 | 0,69 | (0,31, 1,56) | 74 | 0,15 | (0,04, 0,52) |
| Без мутації | 119 | 0,11 | (0,07, 0,19) | 103 | 0,08 | (0,04, 0,16) |
| Делеція 11q |
|
|
|
|
|
|
| Так | 31 | 0,07 | (0,02, 0,22) | 31 | 0,09 | (0,03, 0,26) |
| Ні | 148 | 0,26 | (0,16, 0,41) | 148 | 0,10 | (0,05, 0,20) |
| Складний |
|
|
|
|
|
|
| каріотип |
|
|
|
|
|
|
| Так | 31 | 0,10 | (0,03, 0,33) | 29 | 0,09 | (0,03, 0,29) |
| Ні | 117 | 0,27 | (0,16, 0,46) | 126 | 0,11 | (0,05, 0,21) |
Пацієнти з ХЛЛ, які отримали принаймні один курс терапії
Безпека
та ефективність застосування лікарського засобу Калквенс для лікування
рецидивуючого або рефрактерного ХЛЛ були оцінені в рандомізованому
мультицентровому відкритому дослідженні фази 3 (ASCEND) за участю 310
пацієнтів, які отримали принаймні один курс терапії, що не включав
інгібітори BCL-2 або інгібітори рецепторів В-клітин. Пацієнти отримували
лікарські засоби за такими схемами лікування: Калквенс як монотерапія
або іделалісиб + ритуксимаб чи бендамустин + ритуксимаб на вибір
дослідника. Учасникам дослідження дозволялося приймати антитромботичні
лікарські засоби. З дослідження були виключені пацієнти, які потребували
отримання антикоагулянтної терапії варфарином або аналогічними
антагоністами вітаміну К.
Пацієнти були рандомізовані в співвідношенні 1:1 та отримували:
Калквенс у дозі 100 мг двічі на добу до прогресування захворювання або неприйнятної токсичності або
На вибір дослідника:
Іделалісиб у дозі 150 мг двічі на добу у комбінації з ритуксимабом у
дозі 375 мг/м2 внутрішньовенно у день 1 першого циклу, потім у дозі 500
мг/м2 внутрішньовенно кожні 2 тижні до отримання 4 доз, а потім кожні 4
тижні до отримання 3 доз, що загалом відповідає 8 інфузіям.
Бендамустин у дозі 70 мг/м2 (у дні 1 та 2 кожного 28-денного циклу) у
комбінації з ритуксимабом (375 мг/м2/ 500 мг/м2) у день 1 кожного
28-денного циклу протягом до 6 циклів.
Пацієнти були
стратифіковані за мутаційним статусом делеції ділянки 17p хромосоми (за
наявністю або відсутністю), функціональним статусом за шкалою ECOG (0
або 1 проти 2) та кількістю отриманих курсів терапії (1–3 проти ≥ 4).
Після підтвердження прогресування захворювання 35 пацієнтів, які були
рандомізовані на вибір дослідника для отримання комбінації іделалісиб +
ритуксимаб або бендамустин + ритуксимаб, перейшли на Калквенс як
монотерапію. У таблиці 4 наведено демографічні дані та характеристики
захворювання досліджуваної популяції.
Таблиця 4
Характеристики пацієнтів із ХЛЛ (у дослідженні ASCEND)
Характеристика | Калквенс монотерапія N = 155 | Іделалісиб + ритуксимаб або бендамустин + ритуксимаб на вибір дослідника N = 155 |
| Медіана віку в роках (діапазон) | 68 (32–89) | 67 (34–90) |
| Чоловіки, % | 69,7 | 64,5 |
| Представники європеоїдної раси, % | 93,5 | 91,0 |
| Функціональний статус за шкалою ECOG, % |
|
|
| 0 | 37,4 | 35,5 |
| 1 | 50,3 | 51,0 |
| 2 | 12,3 | 13,5 |
| Медіана часу з моменту діагнозу (місяці) | 85,3 | 79,0 |
| Генералізована лімфаденопатія з вузлами ≥ 5 см, % | 49,0 | 48,4 |
| Медіана кількості отриманих курсів терапії ХЛЛ (діапазон) | 1 (1–8) | 2 (1–10) |
| Кількість отриманих курсів терапії ХЛЛ, % |
|
|
| 1 | 52,9 | 43,2 |
| 2 | 25,8 | 29,7 |
| 3 | 11,0 | 15,5 |
| ≥ 4 | 10,3 | 11,6 |
| Цитогенетичний профіль/ хромосомна аномалія, досліджена методом флуоресцентної гібридизації in situ, % |
|
|
| Делеція ділянки 17p хромосоми | 18,1 | 13,5 |
| Делеція ділянки 11q хромосоми | 25,2 | 28,4 |
| Мутація гена TP53 | 25,2 | 21,9 |
| Немутований ген варіабельних важких ланцюгів імуноглобуліну | 76,1 | 80,6 |
| Складний каріотип (≥ 3 аномалій) | 32,3 | 29,7 |
| Стадія ХЛЛ за Rai, % |
|
|
| 0 | 1,3 | 2,6 |
| I | 25,2 | 20,6 |
| II | 31,6 | 34,8 |
| III | 13,5 | 11,6 |
| IV | 28,4 | 29,7 |
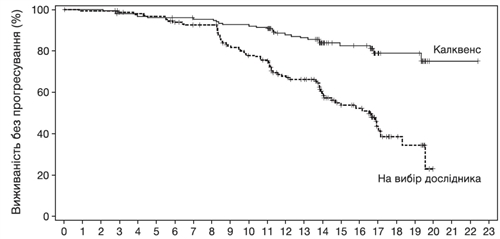
Первинною кінцевою точкою була ВБП за оцінкою НЕК відповідно до критеріїв Міжнародного семінару з хронічного лімфоцитарного лейкозу (IWCLL), проведеного у 2008 році, із включенням роз’яснення щодо лімфоцитозу, пов’язаного з лікуванням (Cheson 2012). При медіані подальшого спостереження 16,1 місяця ВБП показала статистично значуще зниження ризику смерті або прогресування захворювання на 69 % у групі пацієнтів, які отримували Калквенс. Результати оцінки ефективності наведено в таблиці 5. Криві Каплана – Мейєра для ВБП наведено на рисунку 2.
Таблиця 5
Ефективність застосування для лікування пацієнтів із ХЛЛ за оцінкою НЕК (у дослідженні ASCEND)
|
Показник | Калквенс, монотерапія N = 155 | Іделалісиб + ритуксимаб або бендамустин + ритуксимаб на вибір дослідника N = 155 |
| Виживаність без прогресування* | ||
| Кількість подій (%) | 27 (17,4) | 68 (43,9) |
| ПЗ, n (%) | 19 (12,3) | 59 (38,1) |
| Летальні наслідки (%) | 8 (5,2) | 9 (5,8) |
| Медіана (95 % ДІ), місяці | н. д. | 16,5 (14,0, 17,1) |
| ВР† (95 % ДІ) | 0,31 (0,20, 0,49) | |
| P-значення | < 0,0001 | |
| Розрахунок за 15 місяців, % (95 % ДІ) | 82,6 (75,0, 88,1) | 54,9 (45,4, 63,5) |
| Загальна виживаністьa | ||
| Летальні наслідки (%) | 15 (9,7) | 18 (11,6) |
| Відношення ризиків (95 % ДІ)† | 0,84 (0,42, 1,66) | - |
| Найкраща загальна частота відповіді* (ПВ + ПВн + ЧВм + ЧВ)** | ||
| ЗЧВ, n (%) | 126 (81,3) | 117 (75,5) |
| (95 % ДІ) | (74,4, 86,6) | (68,1, 81,6) |
| P-значення | 0,2248 | - |
| ПВ, n (%) | 0 | 2 (1,3) |
| ЧВn, n (%) | 126 (81,3) | 115 (74,2) |
| Тривалість відповіді (ТВ) | ||
| Медіана (95 % ДІ), місяці | н.д. | 13,6 (11,9, н.д.) |
ПЗ – прогресування захворювання; ДІ – довірчий інтервал; ВР – відношення ризиків; н. д. – не досягнуто; ПВ – повна відповідь; ПВн – повна відповідь із неповним відновленням параметрів крові; ЧВn – часткова нодулярна відповідь; ЧВ – часткова відповідь.
* За оцінкою НЕК.
a Медіана ЗВ не була досягнута в обох групах. P-значення для ЗВ становило < 0,6089.
** ПВн та ЧВn становлять 0.
† На основі стратифікованої моделі пропорційних ризиків Кокса.
На основі довгострокових даних медіана подальшого спостереження становила 22,1 місяця у групі пацієнтів, які отримували Калквенс, і 21,9 місяця у групі пацієнтів, які отримували іделалісиб + ритуксимаб або бендамустин + ритуксимаб (ІР/БР). Медіана ВБП не була досягнута у групі пацієнтів, які отримували Калквенс, і становила 16,8 місяця у групі пацієнтів, які отримували ІР/БР. Відношення ризиків для оціненої дослідником ВБП у групі пацієнтів, які отримували Калквенс, становило 0,27 [95 % ДІ, від 0,18 до 0,40] порівняно з групою пацієнтів, які отримували ІР/БР, що на 73 % знижує ризик смерті або прогресування захворювання у групі пацієнтів, які отримували Калквенс. Результати виконаної дослідником оцінки ефективності наведено в таблиці 6.
Таблиця 6
Ефективність застосування для лікування пацієнтів із ХЛЛ за оцінкою дослідника, виконаною під час довготривалого подальшого спостереження (у дослідженні ASCEND)
Показник | Калквенс, монотерапія N = 155 | Іделалісиб + ритуксимаб або бендамустин + ритуксимаб на вибір дослідника N = 155 |
| Виживаність без прогресування* | ||
| Кількість подій (%) | 35 (22,6) | 90 (58,1) |
| ПЗ, n (%) | 23 (14,8) | 79 (51) |
| Летальні наслідки (%) | 12 (7,7) | 11 (7,1) |
| Медіана (95 % ДІ), місяці | н. д. | 16,8 (14,1, 22,4) |
| ВР† (95 % ДІ) | 0,27 (0,18, 0,40) | |
| Розрахунок за 21 місяць, % (95 % ДІ) | 79,1 (71,5, 84,8) | 45,3 (36,9, 53,4) |
| Загальна виживаністьa | ||
| Летальні наслідки (%) | 21 (13,5) | 26 (16,8) |
| Відношення ризиків (95 % ДІ)† | 0,78 (0,44, 1,40) | - |
| Найкраща загальна частота відповіді* (ПВ + ПВн + ЧВn+ ЧВ) ** | ||
| ЗЧВ, n (%) | 124 (80) | 130 (83,9) |
| (95 % ДІ) | (73, 85,5) | (77,3, 88,8) |
| P-значення | 0,3516 | - |
| ПВ, n (%) | 5 (3,2) | 6 (3,9) |
| ЧВn, n (%) | 114 (73,5) | 122 (78,7) |
| Тривалість відповіді (ТВ) | ||
| Медіана (95 % ДІ), місяці | н. д. | 18 (11,9, 19,8) |
ДІ – довірчий інтервал; ВР – відношення ризиків; н. д. – не досягнуто; ПВ – повна відповідь; ПВн – повна відповідь із неповним відновленням параметрів крові; ЧВn – часткова нодулярна відповідь; ЧВ – часткова відповідь; ПЗ – прогресування захворювання.
* За оцінкою дослідника.
a Медіана ЗВ не була досягнута в обох групах. P-значення для ЗВ становило < 0,4094.
** ПВн та ЧВn становлять 2 та 5 відповідно.
† На основі стратифікованої моделі пропорційних ризиків Кокса.
Час від рандомізації (місяців)
|
| Кількість пацієнтів у групі ризику |
| |||||||||||||||||||||||
| Місяць | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| Калквенс | 155 | 153 | 153 | 149 | 147 | 146 | 145 | 143 | 143 | 139 | 139 | 137 | 118 | 116 | 73 | 61 | 60 | 25 | 21 | 21 | 1 | 1 | 1 | 0 | |
| На вибір дослідника | 155 | 150 | 150 | 146 | 144 | 142 | 136 | 130 | 129 | 112 | 105 | 101 | 82 | 77 | 56 | 44 | 39 | 18 | 10 | 8 | 0 |
|
|
| |
Рис. 2. Крива Каплана – Мейєра для ВБП у пацієнтів із ХЛЛ (ITT-популяція) за оцінкою НЕК (у дослідженні ASCEND).
Результати ВБП для лікарського засобу Калквенс були аналогічними у всіх підгрупах, включно з підгрупами з ознаками високого ризику. У популяції ХЛЛ із високим ризиком (з делецією 17p, делецією 11q, мутацією гена TP53 та немутованим геном варіабельних важких ланцюгів імуноглобуліну) ВР для ВБП становило 0,25 [95 % ДІ (0,16, 0,38)].
Таблиця 7
Аналіз ВБП у підгрупах (у дослідженні ASCEND)
Показник | Калквенс як монотерапія | ||
| N | Відношення ризиків | 95 % ДІ | |
| Усі пацієнти | 155 | 0,27 | (0,18, 0,40) |
| Делеція 17p |
|
|
|
| Так | 28 | 0,18 | (0,07, 0,43) |
| Ні | 127 | 0,30 | (0,19, 0,47) |
| Мутація гена TP53 |
|
|
|
| Так | 39 | 0,17 | (0,08, 0,37) |
| Ні | 113 | 0,33 | (0,21, 0,52) |
| Делеція 17p або мутація TP53 |
|
|
|
| Так | 45 | 0,16 | (0,08, 0,34) |
| Ні | 108 | 0,34 | (0,22, 0,55) |
| Мутація гена варіабельних важких ланцюгів імуноглобуліну |
|
|
|
| З мутацією | 33 | 0,30 | (0,12, 0,76) |
| Без мутації | 118 | 0,28 | (0,18, 0,43) |
| Делеція 11q |
|
|
|
| Так | 39 | 0,35 | (0,16, 0,75) |
| Ні | 116 | 0,26 | (0,16, 0,41) |
| Складний каріотип |
|
|
|
| Так | 50 | 0,28 | (0,15, 0,53) |
| Ні | 97 | 0,25 | (0,15, 0,44) |
Пацієнти дитячого віку
Європейське
агентство з лікарських засобів дозволило не подавати результати
досліджень із застосування лікарського засобу Калквенс в усіх підгрупах
пацієнтів дитячого віку з ХЛЛ (див. розділ «Спосіб застосування та дози»
для отримання інформації щодо застосування дітям).
Фармакокінетика.
Фармакокінетика
акалабрутинібу та його активного метаболіту АСР-5862 була вивчена в
дослідженнях за участю здорових осіб та пацієнтів із В-клітинними
лімфопроліферативними захворюваннями. Для акалабрутинібу характерна
дозозалежність, при чому фармакокінетичні показники як для
акалабрутинібу, так і ACP-5862 є майже лінійними в діапазоні доз від 75
до 250 мг. За даними популяційного фармакокінетичного моделювання,
фармакокінетика акалабрутинібу та АСР-5862 є подібною у пацієнтів із
різними B-клітинними лімфопроліферативними захворюваннями. У пацієнтів
із В-клітинними лімфопроліферативними захворюваннями (у тому числі у
пацієнтів із ХЛЛ) середнє геометричне площі під кривою
«концентрація-час» при досягненні рівноважного стану в розрахунку за
добу (AUC24h) для акалабрутинібу та АСР-5862 становило 1679 нг × год/мл і
438 нг/мл, а максимальна концентрація акалабрутинібу в плазмі (Cmax) –
4166 нг × год/мл і 446 нг/мл відповідно при прийомі препарату в
рекомендованих дозах 100 мг двічі на добу.
Абсорбція
Час
досягнення максимальної концентрації акалабрутинібу та АСР-5862 в плазмі
(Тmax) становив 0,5–1,5 години і 1 годину відповідно. Абсолютна
біодоступність лікарського засобу Калквенс становила 25 %.
Вплив їжі на акалабрутиніб
У
здорових осіб прийом одноразової дози 75 мг акалабрутинібу з їжею з
високим вмістом жирів та калорій (приблизно 918 ккал, 59 г вуглеводів,
59 г жирів та 39 г білків) не впливав на середнє значення AUC у
порівнянні з прийомом препарату натще. При цьому Сmax зменшилася на 69
%, а Тmax збільшився на 1–2 години.
Розподіл
Оборотне
зв’язування з білками плазми людини становило 99,4 % для акалабрутинібу
та 98,8 % для АСР-5862. Середнє співвідношення концентрацій у крові та
плазмі in vitro становило 0,8 для акалабрутинібу та 0,7 для АСР-5862.
Середній об’єм розподілу акалабрутинібу в рівноважному стані (Vss)
становив приблизно 34 л.
Біотрансформація/метаболізм
In
vitro акалабрутиніб переважно метаболізується за участю ферментів CYP3A
та меншою мірою – шляхом кон’югації з глутатіоном і гідролізу амідів.
АСР-5862 є основним метаболітом у плазмі крові, який в подальшому
метаболізується переважно за рахунок CYP3A-опосередкованого окиснення і
середнє геометричне експозиції (AUC) якого приблизно в 2–3 рази більше,
ніж акалабрутинібу. АСР-5862 приблизно на 50 % менш ефективно пригнічує
ТКБ, ніж акалабрутиніб.
Результати досліджень in vitro свідчать
про те, що акалабрутиніб не інгібує CYP1A2, CYP2B6, CYP2C8, CYP2C9,
CYP2C19, CYP2D6, UGT1A1 або UGT2B7 у клінічно значущих концентраціях.
Його вплив на кліренс субстратів цих CYP є малоймовірним.
Результати
досліджень in vitro свідчать про те, що ACP-5862 не інгібує CYP1A2,
CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4/5, UGT1A1 або UGT2B7 у
клінічно значущих концентраціях. Його вплив на кліренс субстратів цих
CYP є малоймовірним.
Взаємодія з транспортними білками
Результати
досліджень in vitro свідчать про те, що акалабрутиніб і ACP-5862 є
субстратами P-gp і BCRP. Однак малоймовірно, що супутнє застосування з
інгібіторами BCRP призведе до клінічно значущих взаємодій з іншими
лікарськими засобами. Супутнє застосування з інгібітором OATP1B1/1B3
(600 мг рифампіцину, одноразова доза) призводило до збільшення Cmax і
AUC акалабрутинібу в 1,2 і 1,4 раза (N = 24, здорові добровольці)
відповідно, що не є клінічно значущим.
Акалабрутиніб і ACP-5862
не інгібують P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 та MATE2-K у
клінічно значущих концентраціях. У клінічно значущих концентраціях
акалабрутиніб може інгібувати BCRP у кишечнику, тоді як ACP-5862 може
інгібувати MATE1 (див. розділ «Взаємодія з іншими лікарськими засобами
та інші види взаємодій»). Акалабрутиніб не інгібує MATE1, а ACP-5862 не
інгібує BCRP у клінічно значущих концентраціях.
Виведення
Після
одноразового перорального прийому акалабрутинібу в дозі 100 мг період
його напіввиведення (t1/2) становив 1–2 години. t1/2 активного
метаболіту ACP-5862 становив приблизно 7 годин.
Середній уявний
пероральний кліренс (CL/F) у пацієнтів із B-клітинними
лімфопроліферативними захворюваннями становив 134 л/год і 22 л/год для
акалабрутинібу та АСР-5862 відповідно.
Після одноразового прийому
здоровими добровольцями 100 мг акалабрутинібу, міченого радіоактивним
ізотопом 14С, 84 % прийнятої дози виводилося з фекаліями, 12 % – з
сечею; менше 2 % виводилося в незміненому вигляді.
Особливі категорії пацієнтів
За
даними популяційного фармакокінетичного аналізу, вік (від 18 років),
стать, раса (європеоїдна раса, афроамериканці) і маса тіла пацієнта не
мали клінічно значущого впливу на фармакокінетику акалабрутинібу та його
активного метаболіту АСР-5862.
Пацієнти дитячого віку
Фармакокінетичні дослідження лікарського засобу Калквенс за участю пацієнтів віком до 18 років не проводилися.
Пацієнти з нирковою недостатністю
Акалабрутиніб
виводиться з сечею у мінімальному об’ємі. Дослідження фармакокінетики
за участю пацієнтів із нирковою недостатністю не проводилися.
За
даними популяційного фармакокінетичного аналізу не було виявлено
клінічно значущих відмінностей щодо фармакокінетики між 408 пацієнтами з
легкою нирковою недостатністю (розрахункова швидкість клубочкової
фільтрації (рШКФ) від 60 до 89 мл/хв/1,73 м2), 109 пацієнтами з помірною
нирковою недостатністю (рШКФ від 30 до 59 мл/хв/1,73 м2) та 192
пацієнтами з нормальною функцією нирок (рШКФ більше або дорівнює 90
мл/хв/1,73 м2). Фармакокінетика акалабрутинібу не вивчалась у пацієнтів з
тяжкою нирковою недостатністю (рШКФ <29 мл/хв/1,73 м2) та пацієнтів з
нирковою недостатністю, які потребували проведення діалізу. У клінічні
дослідження не включалися пацієнти з рівнем креатиніну, у 2,5 раза
більшим за встановлену верхню межу норми (ВМН) (див. розділ «Спосіб
застосування та дози»).
Пацієнти з печінковою недостатністю
Акалабрутиніб
метаболізується у печінці. У спеціальних дослідженнях фармакокінетики
акалабрутинібу у пацієнтів з легкою (n = 6, клас А за класифікацією
Чайлда – П’ю), помірною (n = 6, клас В за класифікацією Чайлда – П’ю) та
тяжкою (n = 8, клас С за класифікацією Чайлда – П’ю) печінковою
недостатністю було відзначено збільшення AUC відповідно у 1,9, 1,5 і 5,3
раза порівняно з пацієнтами з нормальною функцією печінки (n = 6).
Проте не було виявлено значущих змін з точки зору виведення препарату у
пацієнтів з помірною печінковою недостатністю, тому її вплив, ймовірно,
був недооцінений у цьому дослідженні. За даними популяційного
фармакокінетичного аналізу не було виявлено клінічно значущих
відмінностей між пацієнтами з легкою (n = 79) або помірною печінковою
недостатністю (n = 6) (з концентрацією білірубіну, в 1,5–3 рази більшою
за верхню межу норми [ВМН] при будь-якій активності
аспартатамінотрансферази (ACT)) та пацієнтами з нормальною функцією
печінки (n = 613) (з концентрацією загального білірубіну та активністю
ACT в межах ВМН) (див. розділ «Спосіб застосування та дози»).
Показання
Калквенс
показаний як монотерапія або в комбінації з обінутузумабом для
лікування дорослих пацієнтів із раніше не лікованим хронічним
лімфоцитарним лейкозом (ХЛЛ).
Калквенс показаний як монотерапія
для лікування дорослих пацієнтів із хронічним лімфоцитарним лейкозом
(ХЛЛ), які отримали принаймні один курс терапії.
Протипоказання
Підвищена чутливість до діючої речовини або будь-якої з допоміжних речовин, зазначених у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Акалабрутиніб
і його активний метаболіт переважно метаболізуються ферментом 3A4
цитохрому P450 (CYP3A4), і обидві речовини є субстратами P-глікопротеїну
(P-gp) та білка резистентності раку молочної залози (BCRP).
Діючі речовини, які можуть призводити до підвищення концентрації акалабрутинібу в плазмі крові
Інгібітори CYP3A/P-gp
Супутнє
застосування акалабрутинібу із сильним інгібітором CYP3A/P-gp (200 мг
ітраконазолу один раз на добу протягом 5 днів) у здорових добровольців
(n = 17) призводило до збільшення Cmax акалабрутинібу в 3,9 раза, а AUC –
в 5 разів.
Слід уникати супутнього застосування із сильними
інгібіторами CYP3A/P-gp. Потрібно тимчасово припинити терапію лікарським
засобом Калквенс, якщо передбачається короткочасне застосування сильних
інгібіторів CYP3A/P-gp (наприклад кетоконазолу, коніваптану,
кларитроміцину, індинавіру, ітраконазолу, ритонавіру, телапревіру,
позаконазолу, вориконазолу) (див. розділ «Спосіб застосування та дози»).
Одночасне
застосування лікарського засобу з помірними інгібіторами CYP3A (400 мг
флуконазолу як одноразова доза або 200 мг ізавуконазолу в режимі
повторюваного дозування протягом 5 діб) у здорових добровольців
збільшувало Cmax і AUC акалабрутинібу від 1,4 до 2 разів, тоді як Cmax і
AUC його активного метаболіту ACP-5862 зменшилися від 0,65 раза до 0,88
раза порівняно з тим, коли акалабрутиніб застосовувався окремо. У разі
застосування комбінації з помірними інгібіторами CYP3A корекція дози не
потрібна, проте слід контролювати стан пацієнтів з метою виявлення
побічних реакцій (див. розділ «Спосіб застосування та дози»).
Діючі речовини, які можуть призводити до зниження концентрації акалабрутинібу в плазмі крові
Індуктори CYP3A
Супутнє
застосування акалабрутинібу із сильним індуктором CYP3A (600 мг
рифампіцину один раз на добу протягом 9 днів) у здорових добровольців (n
= 24) призводило до зменшення Cmax акалабрутинібу на 68 %, а AUC – на
77 %.
Слід уникати супутнього застосування із сильними
індукторами CYP3A (наприклад фенітоїном, рифампіцином, карбамазепіном).
Слід уникати супутнього застосування звіробою, оскільки він може
непередбачувано знизити концентрацію акалабрутинібу в плазмі крові.
Лікарські засоби, що знижують кислотність шлункового соку
Розчинність
акалабрутинібу зменшується зі збільшенням pH. Супутнє застосування
акалабрутинібу з антацидом (1 г кальцію карбонату) у здорових
добровольців призводило до зменшення AUC акалабрутинібу на 53 %. Супутнє
застосування з інгібітором протонної помпи (40 мг омепразолу протягом 5
днів) знижує AUC акалабрутинібу на 43 %.
У разі необхідності
застосування лікарського засобу, що знижує кислотність шлункового соку,
слід розглянути можливість призначення антацидного лікарського засобу
(наприклад карбонату кальцію) або антагоніста Н2-рецепторів (наприклад
ранітидину або фамотидину). При супутньому застосуванні з антацидними
лікарськими засобами інтервал між прийомами лікарського засобу повинен
становити не менше 2 годин (див. розділ «Спосіб застосування та дози»).
Калквенс слід приймати за 2 години до або через 10 годин після
застосування антагоністів Н2-рецепторів.
Роздільне застосування
інгібіторів протонної помпи та лікарського засобу Калквенс може не
усунути взаємодії між ними через тривалу дію інгібіторів протонної
помпи, і тому слід уникати їхнього супутнього застосування (див. розділ
«Спосіб застосування та дози»).
Діючі речовини, концентрація яких в плазмі крові може змінюватися через застосування лікарського засобу Калквенс
Субстрати CYP3A
На
підставі даних досліджень in vitro не можна виключити, що акалабрутиніб
інгібує CYP3A4 у кишечнику і може збільшувати експозицію субстратів
CYP3A4, чутливих до метаболізму CYP3A, в кишечнику. Слід дотримуватися
обережності при супутньому застосуванні акалабрутинібу з пероральними
субстратами CYP3A4 з вузьким терапевтичним діапазоном (наприклад з
циклоспорином, ерготаміном, пімозидом).
Вплив акалабрутинібу на субстрати CYP1A2
Дослідження
in vitro свідчать про те, що акалабрутиніб індукує CYP1A2. Супутнє
застосування акалабрутинібу із субстратами CYP1A2 (наприклад теофіліном,
кофеїном) може знизити їхню експозицію.
Вплив акалабрутинібу та його активного метаболіту ACP-5862 на систему транспорту лікарського засобу
При
супутньому застосуванні субстратів білка резистентності раку молочної
залози (BCRP) (наприклад метотрексату) акалабрутиніб може збільшувати
їхню експозицію через пригнічення цього білка в кишечнику (див. розділ
«Фармакокінетика»). Щоб звести до мінімуму можливість взаємодії у
шлунково-кишковому тракті, пероральні субстрати BCRP з вузьким
терапевтичним діапазоном, такі як метотрексат, слід приймати принаймні
за 6 годин до або після прийому акалабрутинібу.
АСР-5862 може
збільшувати експозицію субстратів білка екструзії лікарських засобів та
токсинів 1 (МАТЕ1) (наприклад метформіну) при їхньому супутньому
застосуванні через пригнічення МАТЕ1 (див. розділ «Фармакокінетика»). У
разі супутнього прийому лікарських засобів з MATE1-залежним розподілом
(наприклад метформін), необхідне ретельне спостереження за станом
пацієнта щодо виявлення змін переносимості внаслідок підвищення
експозиції супутнього лікарського засобу на тлі прийому препарату
Калквенс.
Особливості щодо застосування
Кровотечі
У
пацієнтів із гемобластозами, які отримували лікарський засіб Калквенс як
монотерапію і в комбінації з обінутузумабом, спостерігалися масивні
кровотечі, в тому числі кровотечі з ураженням центральної нервової
системи і шлунково-кишкові кровотечі, деякі з летальним наслідком. Ці
кровотечі спостерігалися як у пацієнтів із тромбоцитопенією, так і без
неї. Загалом кровотечі, включаючи утворення синців і петехії, були менш
тяжкими (див. розділ «Побічні реакції»).
Механізм розвитку кровотеч до кінця не вивчений.
У
пацієнтів, які приймають антитромботичні лікарські засоби, може бути
підвищений ризик розвитку кровотеч. У разі необхідності одночасного
застосування акалабрутинібу та антитромботичних препаратів, це слід
робити з обережністю, а пацієнти повинні перебувати під пильним медичним
наглядом для виявлення ознак кровотеч. Варфарин або інші антагоністи
вітаміну К не слід приймати одночасно з лікарським засобом Калквенс.
Слід
враховувати користь та ризики тимчасового припинення прийому
лікарського засобу Калквенс на період щонайменше 3 днів до та після
хірургічного втручання.
Інфекції
У пацієнтів із
гемобластозами, які отримували лікарський засіб Калквенс як монотерапію і
в комбінації з обінутузумабом, спостерігалися інфекції (бактеріальні,
вірусні або грибкові) тяжкого ступеня, включаючи летальні. Ці інфекції
переважно виникали при відсутності нейтропенії 3 або 4 ступеня тяжкості,
при цьому нейтропенічна інфекція спостерігалася у 1,9 % пацієнтів.
Спостерігалися випадки інфекцій, спричинених реактивацією вірусу
гепатиту В (ВГВ), оперізуючого герпесу, аспергільозом, а також випадки
прогресуючої мультифокальної лейкоенцефалопатії (ПМЛ) (див. розділ
«Побічні реакції»).
Реактивація вірусів
У пацієнтів, які
отримували Калквенс, спостерігалися випадки реактивації вірусу гепатиту
B. До початку застосування лікарського засобу Калквенс необхідно
встановити статус вірусу гепатиту B (ВГВ). Пацієнтам із позитивними
результатами серологічних досліджень на вірус гепатиту В перед початком
лікування слід проконсультуватися з гепатологами. Слід спостерігати за
станом таких пацієнтів і лікувати згідно з місцевими медичними
стандартами, щоб запобігти реактивації вірусу гепатиту В.
У
пацієнтів, які отримували Калквенс на тлі попередньої або супутньої
імуносупресивної терапії, спостерігалися випадки прогресуючої
мультифокальної лейкоенцефалопатії (ПМЛ), деякі з летальним наслідком.
Лікарям слід враховувати ризик розвитку ПМЛ при диференціальній
діагностиці пацієнтів з новими неврологічними, когнітивними або
поведінковими ознаками чи симптомами або на тлі їх погіршення. У разі
підозри на розвиток ПМЛ слід провести відповідні діагностичні обстеження
і призупинити терапію лікарським засобом Калквенс доти, доки наявність
ПМЛ не буде виключена. При наявності будь-яких сумнівів слід розглянути
можливість направлення до невролога і проведення відповідних
діагностичних обстежень на ПМЛ, включаючи МРТ, бажано з контрастуванням,
аналіз спинномозкової рідини (СМР) на ДНК JC-вірусу (поліомавірус) і
повторні неврологічні обстеження.
Для пацієнтів з підвищеним
відносно норми ризиком виникнення опортуністичних інфекцій слід
розглянути можливість проведення профілактичних заходів. Стан пацієнтів
слід контролювати щодо появи ознак і симптомів інфекції та проводити
необхідну терапію відповідно до прийнятої практики.
Цитопенія
У
пацієнтів із гемобластозами, які отримували лікарський засіб Калквенс
як монотерапію і в комбінації з обінутузумабом, спостерігалися випадки
цитопенії 3 або 4 ступеня тяжкості, включаючи нейтропенію, анемію і
тромбоцитопенію, зумовлені лікуванням. Необхідно проводити розгорнуті
аналізи крові відповідно до медичних показань (див. розділ «Побічні
реакції»).
Другі первинні злоякісні новоутворення
У
пацієнтів із гемобластозами, які отримували лікарський засіб Калквенс як
монотерапію і в комбінації з обінутузумабом, спостерігалися другі
первинні злоякісні новоутворення, включаючи шкірні та не пов’язані зі
шкірою злоякісні новоутворення. Часто спостерігалися випадки розвитку
раку шкіри. Слід спостерігати за станом пацієнтів стосовно розвитку раку
шкіри та рекомендувати пацієнтам уникати тривалого перебування на сонці
(див. розділ «Побічні реакції»).
Фібриляція передсердь
У
пацієнтів із гемобластозами, які отримували лікарський засіб Калквенс як
монотерапію і в комбінації з обінутузумабом, спостерігалася
фібриляція/мерехтіння передсердь. Стан пацієнтів слід контролювати з
метою виявлення появи симптомів фібриляції/мерехтіння передсердь
(наприклад, пальпітація, запаморочення, непритомність, біль у грудній
клітці, задишка) і проводити електрокардіографію відповідно до медичних
показань (див. розділи «Взаємодія з іншими лікарськими засобами та інші
види взаємодій» і «Спосіб застосування та дози»). У пацієнтів, у яких на
тлі терапії лікарським засобом Калквенс розвивається фібриляція
передсердь, слід провести ретельну оцінку ризику розвитку
тромбоемболічної хвороби. Для пацієнтів з високим ризиком розвитку
тромбоемболічної хвороби слід розглянути проведення ретельно
контрольованої терапії антикоагулянтами і альтернативні лікарському
засобу Калквенс варіанти терапії.
Інші лікарські засоби
Супутнє
застосування сильних або помірних інгібіторів CYP3A з лікарським
засобом Калквенс призводить до збільшення експозиції акалабрутинібу в
плазмі крові та, відповідно, підвищує ризик токсичності. І навпаки,
супутнє застосування індукторів CYP3A призводить до зменшення експозиції
лікарського засобу Калквенс в плазмі крові, тому існує ризик
недостатньої ефективності лікування. Слід уникати супутнього
застосування із сильними інгібіторами CYP3A. Потрібно тимчасово
припинити терапію лікарським засобом Калквенс, якщо передбачається
короткочасне застосування таких інгібіторів (наприклад протиінфекційних
препаратів впродовж не більше семи днів). За станом пацієнтів, які
приймають помірний інгібітор CYP3A, слід уважно спостерігати з метою
виявлення ознак токсичності (див. розділи «Спосіб застосування та дози» і
«Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Слід
уникати супутнього застосування із сильними індукторами CYP3A4 через
ризик відсутності ефективності лікування.
Калквенс містить натрій
В 1 дозі цього лікарського засобу міститься менше 1 ммоль натрію (23 мг), тобто його можна вважати таким, що не містить натрію.
Застосування у період вагітності або годування груддю.
Застосування жінками репродуктивного віку
Жінкам репродуктивного віку рекомендується уникати вагітності під час терапії лікарським засобом Калквенс.
Застосування у період вагітності
Дані
щодо застосування акалабрутинібу вагітними жінками відсутні або
обмежені. Результати досліджень на тваринах свідчать про те, що
експозиція акалабрутинібу під час вагітності може становити небезпеку
для плода. У щурів спостерігалася дистоція (важкі або тривалі пологи), а
введення вагітним кролям призводило до сповільнення росту плода.
Калквенс
не слід застосовувати під час вагітності, за винятком випадків, коли
клінічний стан жінки вимагає лікування саме акалабрутинібом.
Застосування у період годування груддю
Невідомо,
чи потрапляє акалабрутиніб у грудне молоко людини. Дані щодо впливу
акалабрутинібу на дітей, які перебувають на грудному вигодовуванні, або
на вироблення грудного молока відсутні. Акалабрутиніб та його активний
метаболіт були виявлені у грудному молоці щурів. Не можна виключити
ризик для дитини, яка перебуває на грудному вигодовуванні. Жінкам
рекомендується уникати годування груддю на період прийому лікарського
засобу Калквенс і протягом 2 днів після отримання останньої дози.
Вплив на репродуктивну функцію
Дані
щодо впливу лікарського засобу Калквенс на репродуктивну функцію людини
відсутні. Результати доклінічного дослідження акалабрутинібу на самцях і
самицях щурів не показали негативного впливу на їхню репродуктивну
функцію.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський
засіб Калквенс не впливає або має незначний вплив на здатність керувати
транспортними засобами та працювати з іншими механізмами. Однак під час
терапії акалабрутинібом можуть виникати стомлюваність та запаморочення,
і при наявності цих симптомів пацієнти повинні бути обережними під час
керування транспортними засобами або роботи з іншими механізмами.
Спосіб застосування та дози
Цей
лікарський засіб повинен призначати лікар, який має досвід застосування
протипухлинних препаратів. Застосовувати лише під наглядом лікаря.
Дози
Рекомендована
доза становить 100 мг акалабрутинібу двічі на добу (що відповідає
загальній добовій дозі 200 мг). Див. інформацію про дозування в
інструкції для медичного застосування обінутузумабу.
Інтервал між дозами повинен становити приблизно 12 годин.
Терапію
лікарським засобом Калквенс необхідно продовжувати до прогресування
захворювання або виникнення неприйнятного токсичного ефекту.
Корекція дози
Побічні реакції
Рекомендації з корекції дози лікарського засобу Калквенс при побічних реакціях 3 ступеня тяжкості та вище наведено в таблиці 8.
Таблиця 8
Рекомендації з корекції дози у разі виникнення побічних реакцій*
Побічна реакція | Кількість виникнення побічної реакції | Корекція дози (Початкова доза = 100 мг приблизно кожні 12 годин) |
| Тромбоцитопенія 3 ступеня тяжкості з кровотечею Тромбоцитопенія 4 ступеня тяжкості або Нейтропенія 4 ступеня тяжкості тривалістю більше 7 днів Негематологічна токсичність 3 ступеня тяжкості та вище | Вперше або вдруге | Тимчасово припиніть терапію лікарським засобом Калквенс Після зменшення токсичного ефекту до 1 ступеня тяжкості або вихідного рівня терапію лікарським засобом Калквенс можна продовжити в дозі 100 мг кожні 12 годин |
| Втретє | Тимчасово припиніть терапію лікарським засобом Калквенс Після зменшення токсичного ефекту до 1 ступеня тяжкості або вихідного рівня терапію лікарським засобом Калквенс можна продовжити зі зменшенням дози до 100 мг один раз на добу | |
| Вчетверте | Повністю припиніть терапію лікарським засобом Калквенс |
*Класифікація побічних реакцій згідно з версією 4.03 Загальних термінологічних критеріїв побічних реакцій Національного інституту раку США (NCI CTCAE).
Взаємодії
Рекомендації щодо застосування лікарського засобу Калквенс з інгібіторами або індукторами CYP3A або лікарськими засобами, що знижують кислотність шлункового соку, наведено у таблиці 9 (див. також розділ інструкції «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Таблиця 9
Застосування з інгібіторами або індукторами CYP3A та лікарськими засобами, що знижують кислотність шлункового соку
Супутній лікарський засіб | Рекомендації щодо застосування лікарського засобу Калквенс | |
| Інгібітори CYP3A | Сильний інгібітор CYP3A | Уникайте супутнього застосування. Тимчасово припиніть терапію лікарським засобом Калквенс, якщо передбачається короткочасне застосування таких лікарських засобів (наприклад протиінфекційних, впродовж не більше семи днів). |
| Помірний інгібітор CYP3A | Корекція дози не потрібна. Контролюйте стан пацієнтів з метою виявлення побічних реакцій у разі прийому помірних інгібіторів CYP3A. | |
| Слабкий інгібітор CYP3A | Корекція дози не потрібна. | |
| Індуктори CYP3A | Сильний індуктор CYP3A | Уникайте супутнього застосування. |
| Лікарські засоби, що знижують кислотність шлункового соку | Інгібітори протонної помпи | Уникайте супутнього застосування. |
| Антагоністи Н2-гістамінових рецепторів | Приймайте лікарський засіб Калквенс за 2 години до або через 10 годин після застосування антагоніста Н2-гістамінових рецепторів. | |
| Антацидні лікарські засоби | Інтервал між прийомом цих лікарських засобів повинен становити не менше 2 годин. | |
Пропуск прийому дози лікарського засобу
Якщо
пацієнт пропустив прийом лікарського засобу Калквенс і з моменту
планового прийому минуло більш ніж 3 години, наступну дозу лікарського
засобу слід прийняти в наступний звичайний запланований час. Не слід
приймати додаткову дозу лікарського засобу для компенсації пропущеної
дози.
Особливі категорії пацієнтів
Пацієнти літнього віку
Пацієнтам літнього віку (≥ 65 років) не потрібна корекція дози (див. розділ «Фармакокінетика»).
Пацієнти з нирковою недостатністю
Спеціальні
дослідження застосування лікарського засобу пацієнтам з нирковою
недостатністю не проводилися. У клінічних дослідженнях лікарського
засобу Калквенс брали участь пацієнти з легкою або помірною нирковою
недостатністю. Пацієнтам з легкою або помірною нирковою недостатністю (з
кліренсом креатиніну більше 30 мл/хв) не потрібна корекція дози.
Необхідно підтримувати належну гідратацію і періодично контролювати
рівень креатиніну в сироватці крові. Калквенс слід призначати пацієнтам з
тяжкою нирковою недостатністю (з кліренсом креатиніну менше 30 мл/хв),
тільки якщо потенційна користь є більшою за ризик. Такі пацієнти
потребують ретельного спостереження з метою виявлення ознак токсичності.
Відсутні дані стосовно пацієнтів з тяжкою нирковою недостатністю або
пацієнтів, які перебували на діалізі (див. розділ «Фармакокінетика»).
Пацієнти з печінковою недостатністю
Пацієнтам
з легкою або помірною печінковою недостатністю (клас А або В за
класифікацією Чайлда – П’ю або при концентрації загального білірубіну, в
1,5–3 рази вищій за верхню межу норми [ВМН], при будь-якій активності
аспартатамінотрансферази [ACT]) не потрібна корекція дози. Проте
пацієнти з помірною печінковою недостатністю потребують ретельного
спостереження з метою виявлення ознак токсичності. Не рекомендується
застосовувати лікарський засіб Калквенс пацієнтам з тяжкою печінковою
недостатністю (клас С за класифікацією Чайлда – П’ю або при концентрації
загального білірубіну, втричі більшій за верхню межу норми, при
будь-якій активності ACT) (див. розділ «Фармакокінетика»).
Пацієнти з серцевими захворюваннями тяжкого ступеня
У клінічні дослідження лікарського засобу Калквенс не включали пацієнтів із серцевими захворюваннями тяжкого ступеня.
Спосіб застосування
Лікарський
засіб Калквенс призначений для перорального застосування. Капсули слід
ковтати цілими, запиваючи водою, приблизно в один і той же час доби і
незалежно від прийому їжі (див. розділ «Взаємодія з іншими лікарськими
засобами та інші види взаємодій»). Капсули не слід розжовувати,
розчиняти у рідині або розкривати, оскільки це може вплинути на
абсорбцію лікарського засобу.
Діти.
Безпека та ефективність застосування лікарського засобу Калквенс дітям (віком до 18 років) не встановлені. Дані відсутні.
Передозування
Симптоми
і специфічне лікування передозування акалабрутинібом не визначені. У
разі передозування пацієнти повинні перебувати під пильним медичним
наглядом для виявлення можливих ознак або симптомів побічних реакцій і у
разі потреби отримувати симптоматичне лікування.
Побічні ефекти
▼Лікарський
засіб знаходиться під додатковим моніторингом. Це дасть змогу швидко
отримувати нову інформацію щодо безпеки. Спеціалістів у галузі охорони
здоров’я просять повідомляти про будь-які підозрювані побічні реакції.
Резюме профілю безпеки
Найбільш
частими (≥ 20 %) побічними реакціями будь-якого ступеня, про які
повідомлялося у 1040 пацієнтів, які отримували лікарський засіб Калквенс
як монотерапію, були інфекція (66,7 %), головний біль (37,8 %), діарея
(36,7 %), утворення синців (34,1 %), м’язово-скелетний біль (33,1 %),
нудота (21,7 %), втомлюваність (21,3 %), кашель (21 %) і висип (20,3 %).
Найбільш частими (≥ 5 %) побічними реакціями 3 ступеня тяжкості та вище
були інфекція (17,6 %), лейкопенія (14,3 %), нейтропенія (14,2 %) та
анемія (7,8 %).
Найбільш частими ( ≥ 20 %) побічними реакціями
будь-якого ступеня, про які повідомлялося у 223 пацієнтів, які
отримували Калквенс у складі комбінованої терапії, були інфекція (74 %),
м’язово-скелетний біль (44,8 %), діарея (43,9 %), головний біль (43 %),
лейкопенія (31,8 %), нейтропенія (31,8 %), кашель (30,5 %),
втомлюваність (30,5 %), артралгія (26,9 %), нудота (26,9 %),
запаморочення (23,8 %) і запор (20,2 %). Найбільш частими (≥ 5 %)
побічними реакціями 3 ступеня тяжкості та вище були лейкопенія (30 %),
нейтропенія (30 %), інфекція (21,5 %), тромбоцитопенія (9 %) та анемія
(5,8 %).
Зведена таблиця побічних реакцій
Нижче наведено
перелік побічних реакцій, про які повідомлялось у ході клінічних
досліджень, проведених за участю пацієнтів, які отримували Калквенс для
лікування гемобластозів. Середня тривалість лікування лікарським засобом
Калквенс у наборі об’єднаних даних становила 26,2 місяця.
Побічні
реакції наведено за класами систем органів з використанням термінів
Медичного словника з питань регуляторної діяльності (MedDRA). У межах
кожного класу систем органів побічні реакції зазначено у порядку
зменшення частоти. Категорії частоти побічних реакцій представлено таким
чином: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто
(від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10 000 до < 1/1000),
дуже рідко (< 1/10000), частота невідома (не можна встановити на
підставі наявних даних). У межах кожної категорії частоти побічні
реакції представлено в порядку зменшення серйозності.
Таблиця 10
Побічні реакції* у пацієнтів із гемобластозами, які отримували монотерапію акалабрутинібом (n = 1040)
Клас органів та систем за MedDRA | Термін за MedDRA | Загальна частота виникнення побічних реакцій (усіх ступенів за CTCAE) | Частота виникнення побічних реакцій 3 ступеня тяжкості та вище за CTCAE† |
| Інфекційні та паразитарні захворювання | Інфекція верхніх дихальних шляхів | Дуже часто (22 %) | 0,8 % |
| Синусит | Дуже часто (10,7 %) | 0,3 % | |
| Пневмонія | Часто (8,7 %) | 5,1 % | |
| Інфекція сечовивідних шляхів | Часто (8,5 %) | 1,5 % | |
| Назофарингіт | Часто (7,4 %) | 0 % | |
| Бронхіт | Часто (7,6 %) | 0,3 % | |
| Герпесвірусні інфекції† | Часто (5,9 %) | 0,7 % | |
| Аспергільоз† | Нечасто (0,5 %) | 0,4 % | |
| Реактивація гепатиту В | Нечасто (0,1 %) | 0,1 % | |
| Доброякісні, злоякісні та неуточнені новоутворення | Друге первинне злоякісне новоутворення† Немеланомний рак шкіри† Друге первинне злоякісне новоутворення (крім немеланомного раку шкіри)† | Дуже часто (12,2 %)
Часто (6,6 %) Часто (6,5 %) | 4,1 % 0,5 % 3,8 % |
| З боку крові та лімфатичної системи | Нейтропенія† | Дуже часто (15,7 %) | 14,2 % |
| Анемія† | Дуже часто (13,8 %) | 7,8 % | |
| Тромбоцитопенія† | Часто (8,9 %) | 4,8 % | |
| Лімфоцитоз | Нечасто (0,3 %) | 0,2 % | |
| З боку обміну речовин та харчування | Синдром лізису пухлини± | Нечасто (0,5 %) | 0,4 % |
| З боку нервової системи | Головний біль | Дуже часто (37,8 %) | 1,1 % |
| Запаморочення | Дуже часто (13,4 %) | 0,2 % | |
| Розлади серцевої діяльності | Фібриляція/ мерехтіння передсердь† | Часто (4,4 %) | 1,3 % |
| З боку судинної системи | Утворення синців† Забої Петехії Екхімози | Дуже часто (34,1 %) Дуже часто (21,7 %) Дуже часто (10,7 %) Часто (6,3 %) | 0 % 0 % 0 % 0 % |
| Кровотеча/гематома† Шлунково-кишкова кровотеча Внутрішньочерепний крововилив | Дуже часто (12,6 %) Часто (2,3 %) Часто (1 %) | 1,8 % 0,6 % 0,5 % | |
| Носова кровотеча | Часто (7 %) | 0,3 % | |
| З боку шлунково-кишкового тракту | Діарея | Дуже часто (36,7 %) | 2,6 % |
| Нудота | Дуже часто (21,7 %) | 1,2 % | |
| Запор | Дуже часто (14,5 %) | 0,1 % | |
| Блювання | Дуже часто (13,3 %) | 0,9 % | |
| Біль у животі† | Дуже часто (12,5 %) | 1 % | |
| З боку шкіри та підшкірної клітковини | Висип† | Дуже часто (20,3 %) | 0,6 % |
| З боку скелетно-м’язової системи та сполучної тканини | М’язово-скелетний біль† | Дуже часто (33,1 %) | 1,5 % |
| Артралгія | Дуже часто (19,1 %) | 0,7 % | |
| Загальні розлади та реакції в місці введення | Втомлюваність | Дуже часто (21,3 %) | 1,7 % |
| Астенія | Часто (5,3 %) | 0,8 % | |
| Відхилення від норми¶ (виявлені за результатами аналізів) | Зниження рівня гемоглобіну§ | Дуже часто (42,6 %) | 10,1 % |
| Зниження абсолютної кількості нейтрофілів§ | Дуже часто (41,8 %) | 20,7 % | |
| Зниження кількості тромбоцитів§ | Дуже часто (31,1 %) | 6,9 % |
*
За класифікацією побічних реакцій згідно з версією 4.03 Загальних
термінологічних критеріїв побічних реакцій Національного інституту раку
США (NCI CTCAE).
† Включає багато термінів, що позначають побічні реакції на лікарські засоби.
±
У групі акалабрутинібу в дослідженні ASCEND був зареєстрований один
випадок розвитку синдрому лізису пухлини, зумовленого прийомом
лікарського засобу.
§ Представляє частоту відхилень лабораторних показників, а не частоту зареєстрованих побічних реакцій.
¶ Представлені як ступені відхилення від норми згідно з CTCAE.
Таблиця 11
Побічні реакції* у пацієнтів із гемобластозами, які отримували комбіновану терапію акалабрутинібом (n = 223)
Клас органів та систем за MedDRA | Термін за MedDRA | Загальна частота виникнення побічних реакцій (усіх ступенів за CTCAE) | Частота виникнення побічних реакцій 3 ступеня тяжкості та вище за CTCAE† |
| Інфекційні та паразитарні захворювання | Інфекція верхніх дихальних шляхів | Дуже часто (31,4 %) | 1,8 % |
| Синусит | Дуже часто (15,2 %) | 0,4 % | |
| Назофарингіт | Дуже часто (13,5 %) | 0,4 % | |
| Інфекція сечовивідних шляхів | Дуже часто (13 %) | 0,9 % | |
| Пневмонія | Дуже часто (10,8 %) | 5,4 % | |
| Бронхіт | Часто (9,9 %) | 0 % | |
| Герпесвірусні інфекції† | Часто (6,7 %) | 1,3 % | |
| Прогресуюча мультифокальна лейкоенцефалопатія | Нечасто (0,4 %) | 0,4 % | |
| Реактивація гепатиту В | Нечасто (0,9 %) | 0,1 % | |
| Аспергільоз† | Дуже рідко (< 0 %) | 0 % | |
| Доброякісні, злоякісні та неуточнені новоутворення | Друге первинне злоякісне новоутворення† Немеланомний рак шкіри† Друге первинне злоякісне новоутворення (крім немеланомного раку шкіри)† | Дуже часто (13 %)
Часто (7,6 %)
Часто (6,3 %) | 4,0 % 0,4 % 3,6 % |
| З боку крові та лімфатичної системи | Нейтропенія† | Дуже часто (31,8 %) | 30 % |
| Тромбоцитопенія† | Дуже часто (13,9 %) | 9 % | |
| Анемія† | Дуже часто (11,7 %) | 5,8 % | |
| Лімфоцитоз | Нечасто (0,4 %) | 0,4 % | |
| З боку обміну речовин та харчування | Синдром лізису пухлини± | Нечасто (1,8 %) | 1,3 % |
| З боку нервової системи | Головний біль | Дуже часто (43 %) | 0,9 % |
| Запаморочення | Дуже часто (23,8 %) | 0 % | |
| Розлади серцевої діяльності | Фібриляція/мерехтіння передсердь† | Часто (3,1 %) | 0,9 % |
| З боку судинної системи | Утворення синців† Забої Петехії Екхімози | Дуже часто (38,6 %) Дуже часто (27,4 %) Дуже часто (11,2 %) Часто (3,1 %) | 0 % 0 % 0 % 0 % |
| Кровотеча/гематома† Шлунково-кишкова кровотеча Внутрішньочерепний крововилив | Дуже часто (17,5 %) Часто (3,6 %) Нечасто (0,9 %) | 1,3 % 0,9 % 0 % | |
| Носова кровотеча | Часто (8,5 %) | 0 % | |
| З боку шлунково-кишкового тракту | Діарея | Дуже часто (43,9 %) | 4,5 % |
| Нудота | Дуже часто (26,9 %) | 0 % | |
| Запор | Дуже часто (20,2 %) | 0 % | |
| Блювання | Дуже часто (19,3 %) | 0,9 % | |
| Біль у животі† | Дуже часто (14,8 %) | 1,3 % | |
| З боку шкіри та підшкірної клітковини | Висип† | Дуже часто (30,9 %) | 1,8 % |
| З боку скелетно-м’язової системи та сполучної тканини | М’язово-скелетний біль† | Дуже часто (44,8 %) | 2,2 % |
| Артралгія | Дуже часто (26,9 %) | 1,3 % | |
| Загальні розлади | Втомлюваність | Дуже часто (30,5 %) | 1,8 % |
| Астенія | Часто (7,6 %) | 0,4 % | |
| Відхилення від норми¶ (виявлені за результатами аналізів) | Зниження абсолютної кількості нейтрофілів§ | Дуже часто (57,4 %) | 35 % |
| Зниження кількості тромбоцитів§ | Дуже часто (46,2 %) | 10,8 % | |
| Зниження рівня гемоглобіну§ | Дуже часто (43,9 %) | 9 % |
*
За класифікацією побічних реакцій згідно з версією 4.03 Загальних
термінологічних критеріїв побічних явищ Національного інституту раку США
(NCI CTCAE).
† Включає багато термінів, що позначають побічні реакції на лікарські засоби.
±
У групі акалабрутинібу в дослідженні ASCEND був зареєстрований один
випадок розвитку синдрому лізису пухлини, зумовленого прийомом
лікарського засобу.
§ Представляє частоту відхилень лабораторних показників, а не частоту зареєстрованих побічних реакцій.
¶ Представлені як ступені відхилення від норми згідно з CTCAE.
Опис деяких побічних реакцій
Зниження дози або припинення терапії внаслідок розвитку побічних реакцій
Із
1040 пацієнтів, які отримували Калквенс як монотерапію, 9,3 % припинили
терапію внаслідок розвитку побічних реакцій. Основні побічні реакції
включали пневмонію, тромбоцитопенію та діарею. 4,2 % пацієнтів
потребували зменшення дози лікарського засобу у зв’язку з розвитком
побічних реакцій. Основні побічні реакції включали реактивацію вірусу
гепатиту В, сепсис та діарею.
Із 223 пацієнтів, які отримували
Калквенс у складі комбінованої терапії, 10,8 % припинили терапію
внаслідок розвитку побічних реакцій. Основні побічні реакції включали
пневмонію, тромбоцитопенію та діарею. 6,7 % пацієнтів потребували
зменшення дози препарату у зв’язку з розвитком побічних реакцій. Основні
побічні реакції включали нейтропенію, діарею та блювання.
Пацієнти літнього віку
Із
1040 учасників клінічних досліджень застосування лікарського засобу
Калквенс як монотерапії 41 % становили пацієнти віком ˃ 65 років та ˂ 75
років, а 22 % – віком понад 75 років. Клінічно значущих відмінностей з
точки зору безпеки або ефективності терапії між пацієнтами віком понад
65 років та молодшими пацієнтами виявлено не було.
Із 223
учасників клінічних досліджень застосування лікарського засобу Калквенс у
комбінації з обінутузумабом 47 % становили пацієнти віком ˃ 65 років та
˂ 75 років, а 26 % – віком понад 75 років. Клінічно значущих
відмінностей з точки зору безпеки або ефективності терапії між
пацієнтами віком ≥ 65 років та молодшими пацієнтами виявлено не було.
Повідомлення про побічні реакції
Важливо
повідомляти про підозрювані побічні реакції у післяреєстраційний період
застосування лікарського засобу. Це дає змогу здійснювати безперервний
моніторинг співвідношення користь/ризик застосування лікарського засобу.
Спеціалісти у галузі охорони здоров’я зобов’язані повідомляти про
будь-які випадки підозрюваних побічних реакцій через національну систему
звітності.
Термін придатності
36 місяців.
Умови зберігання
Зберігати при температурі не вище 30 °C. Зберігати в недоступному для дітей місці.
Упаковка
По
6 твердих капсул у блістері; по 10 блістерів у картонній коробці або по
8 твердих капсул у блістері; по 7 блістерів у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
АстраЗенека АБ / AstraZeneca AB.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Гертуневеген, Содертал’є, 152 57, Швеція / Gartunavagen, Sodertalje, 152 57, Sweden.
| Особливості | |
| Країна: | Швеція |
| Рецептурний: | Рецепт |
| Термін придатності: | 23.12.2026 0:00:00 |
| Номер реєстрації: | UA/19138/01/01 |
| Штрих код: | 5 000 456 066 877 |




